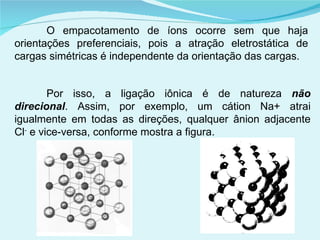
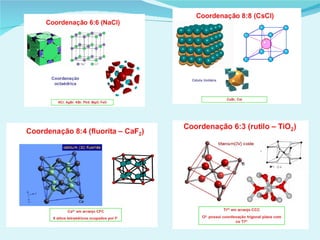
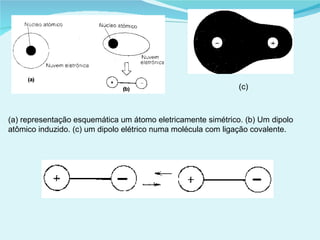
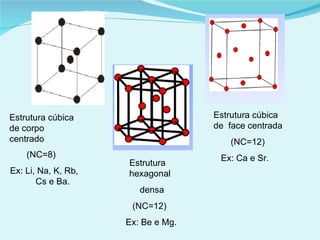
Este documento descreve os diferentes tipos de sólidos e suas propriedades. Existem sólidos cristalinos, que possuem estrutura ordenada, e sólidos amorfos, que são desordenados. Os sólidos cristalinos incluem cristais iônicos, covalentes e metálicos. Os sólidos possuem forma e volume definidos e transformam-se em líquidos ou gases quando aquecidos ou sob pressão reduzida.