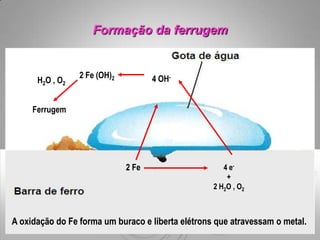
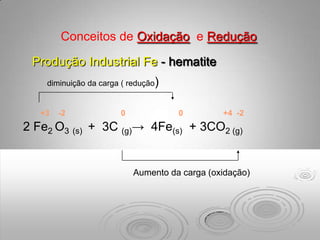
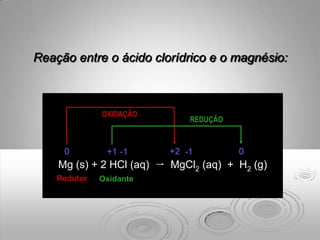
O documento discute os impactos das chuvas ácidas em materiais como carbonatos e metais. As chuvas ácidas reagem com os carbonatos formando dióxido de carbono e depósitos sólidos, e aceleram a corrosão de metais como ferro através de reações de oxidação-redução. O ferro é oxidado pela chuva ácida, formando íons ferrosos e hidrogênio gasoso.