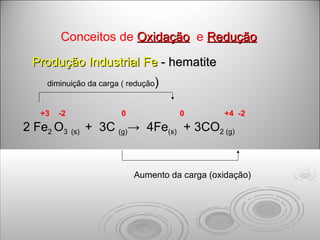
Chuvas ácidas causam a corrosão de metais e a deterioração de pedras através de reações químicas. A água ácida reage com carbonatos formando dióxido de carbono e depósitos sólidos, e com metais formando sais solúveis que corroem as estruturas. A oxidação do ferro por chuva ácida forma ferrugem.