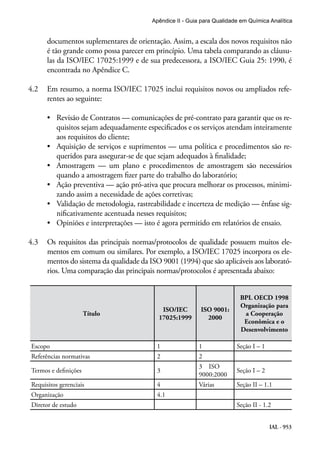
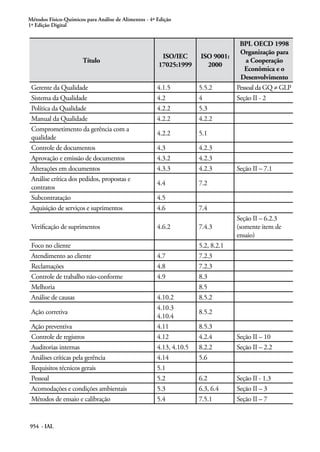
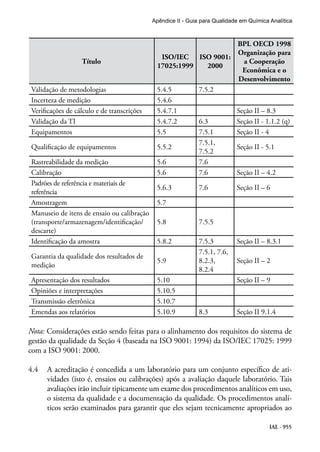
Este documento apresenta um guia para qualidade em química analítica preparado pela CITAC e EURACHEM. O guia fornece diretrizes sobre as melhores práticas para operações analíticas em laboratórios e aborda requisitos da norma ISO/IEC 17025. O documento foi traduzido sob os auspícios da ANVISA e UNESCO para apoiar laboratórios no Brasil.