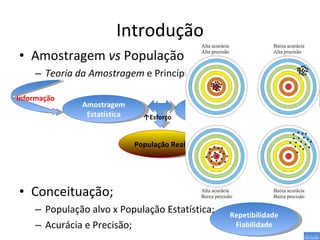
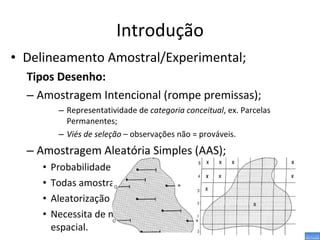
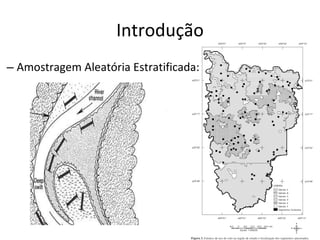
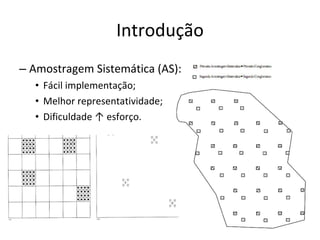
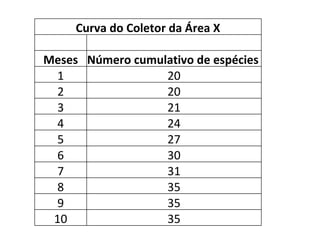
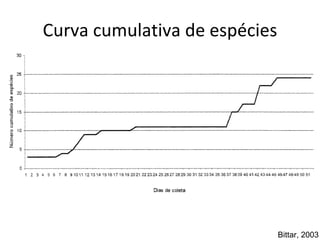
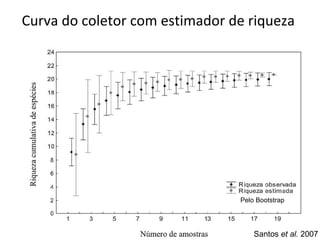
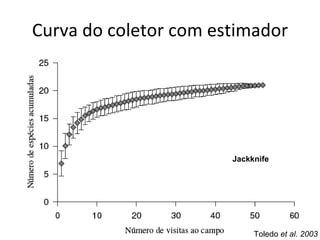
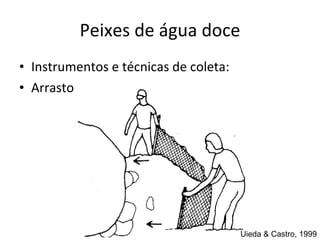
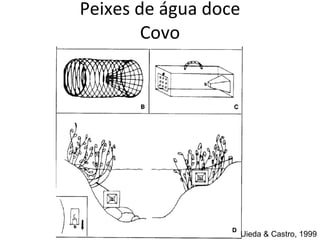
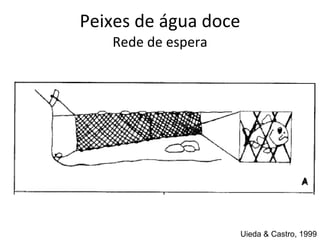
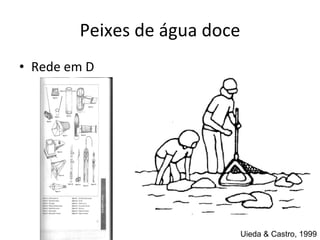
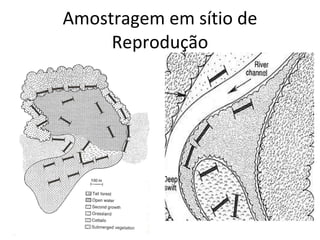
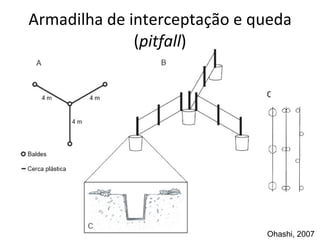
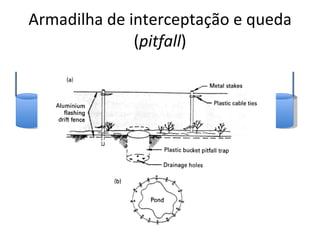
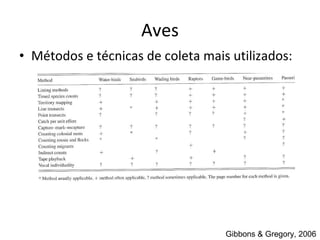
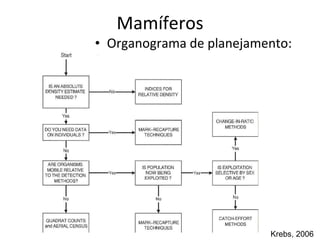
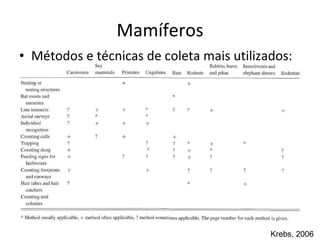
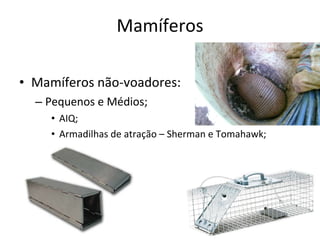
O documento discute métodos de amostragem para estudos de vertebrados, incluindo os principais tipos de amostragem, como amostragem aleatória simples e estratificada. Também aborda técnicas específicas para diferentes grupos, como rede de espera para répteis aquáticos, mist nets para aves e armadilhas para pequenos mamíferos. Finalmente, destaca cuidados importantes durante atividades de coleta de dados no campo.