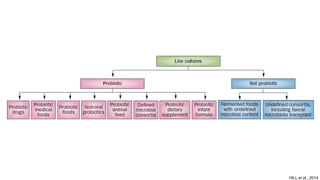
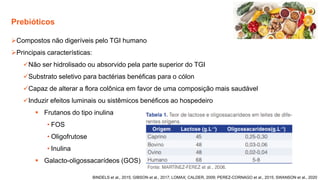
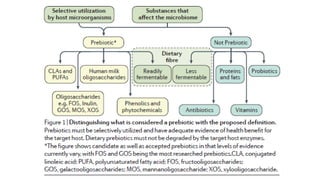
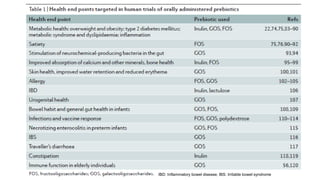
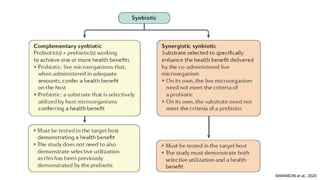
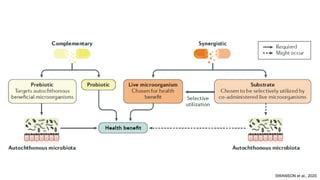
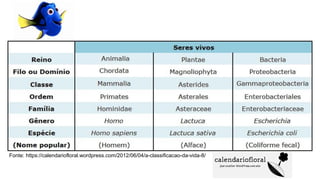
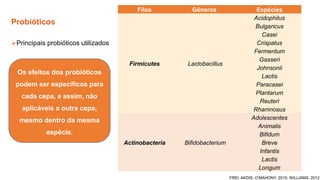
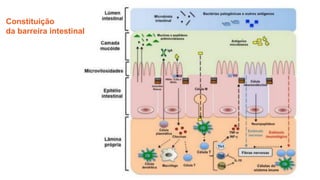
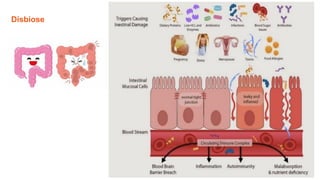
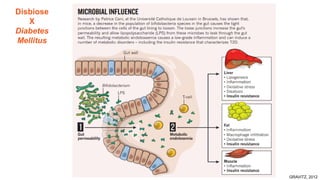
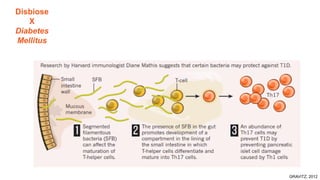
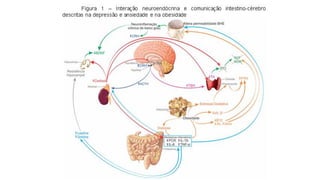
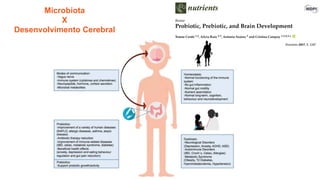
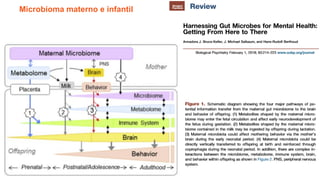
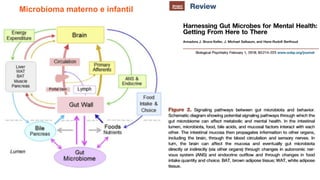
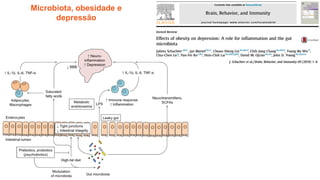
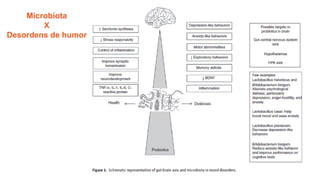
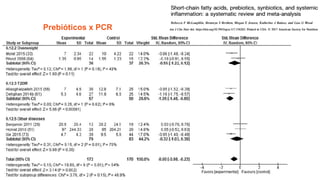
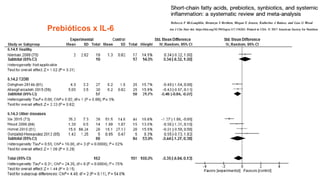
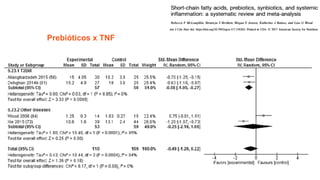
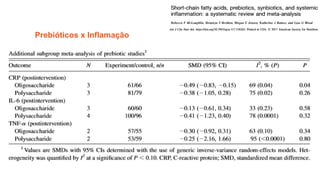
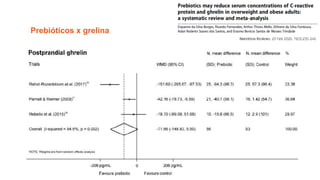
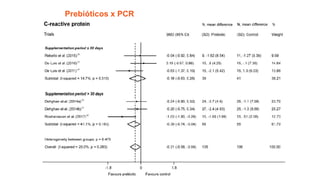
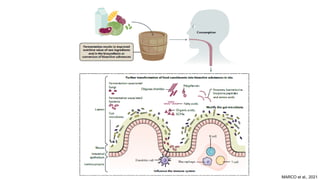
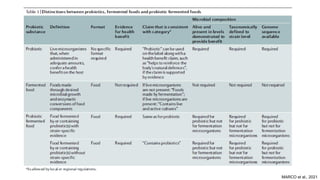
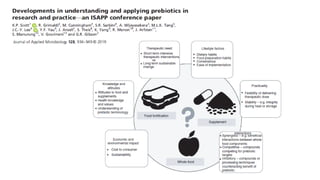
O documento discute probióticos, prebióticos e simbióticos, incluindo suas definições, funções e efeitos na saúde. Também aborda a microbiota intestinal, seu papel na saúde e como pode ser modulada por dietas e suplementos. Há evidências de que esses agentes podem influenciar condições como obesidade, inflamação, depressão e diabetes.