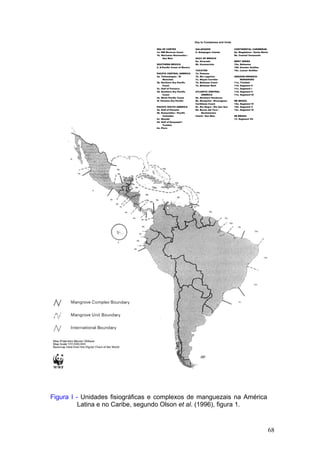
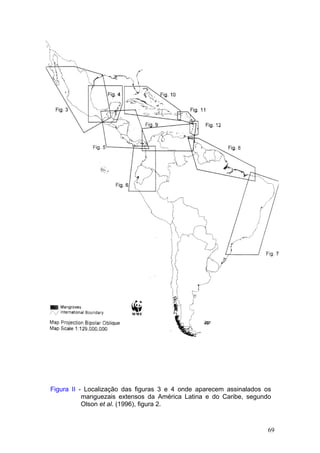
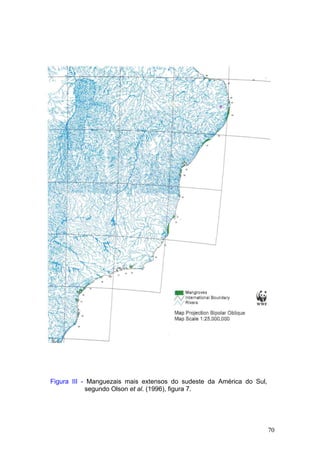
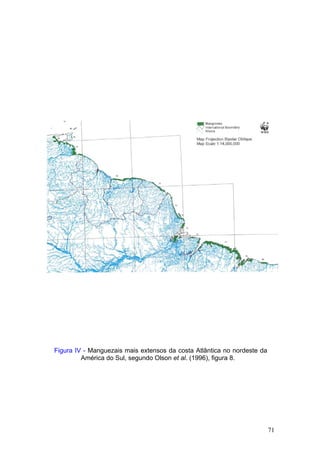
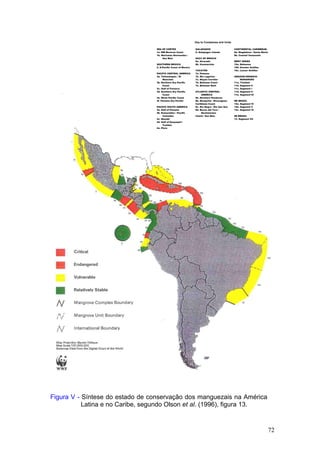
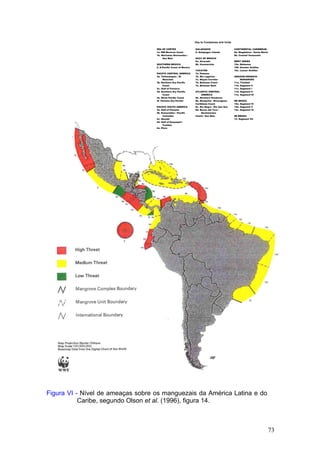
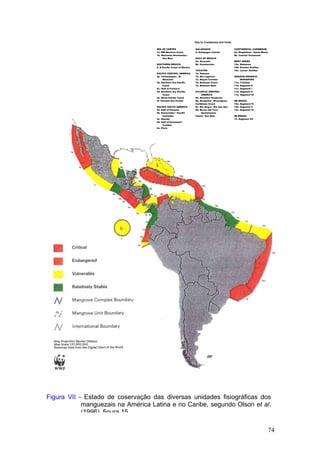
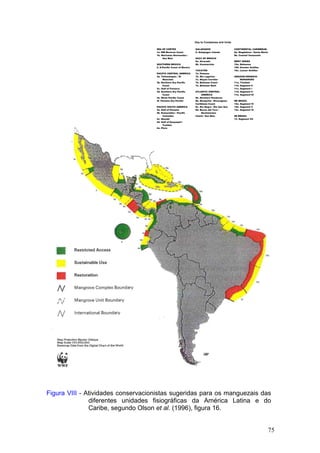
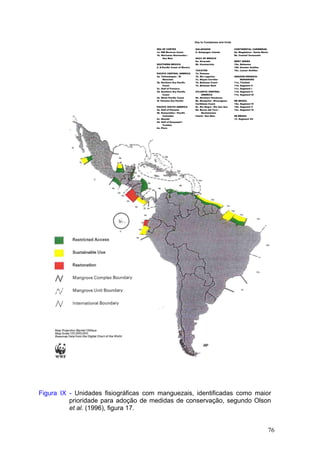
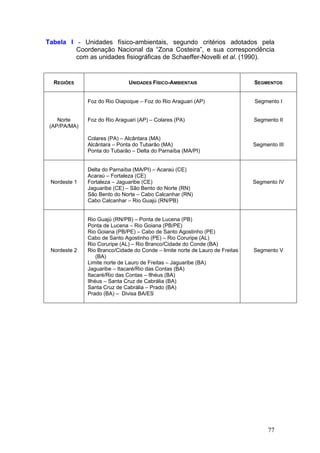
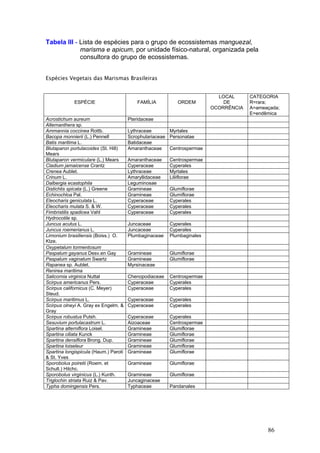
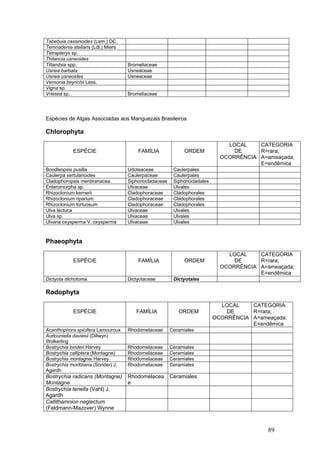
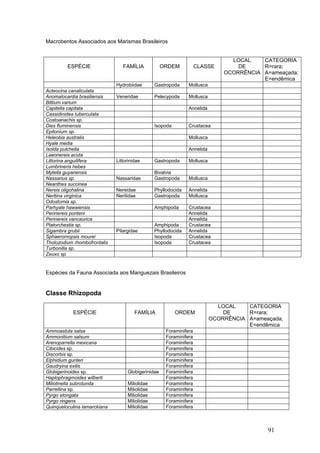
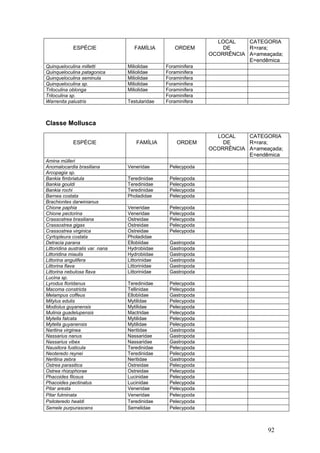
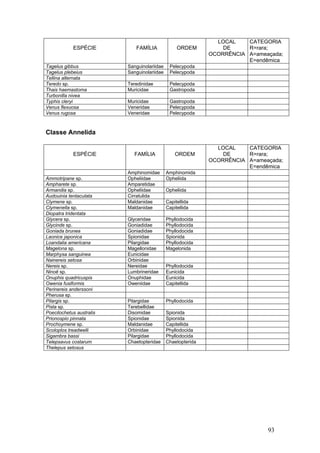
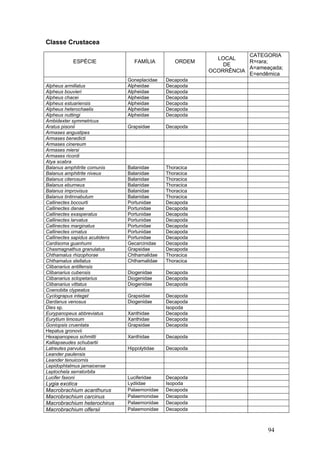
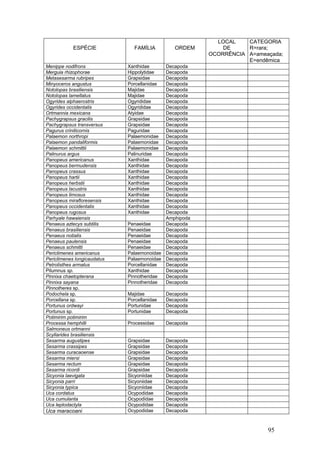
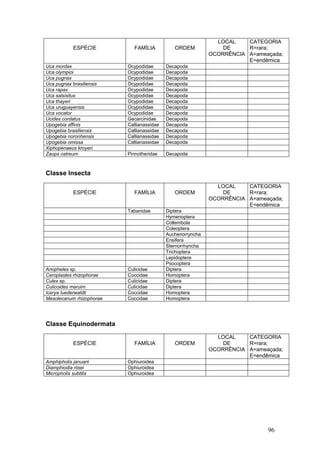
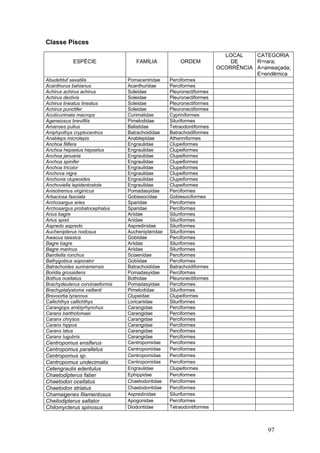
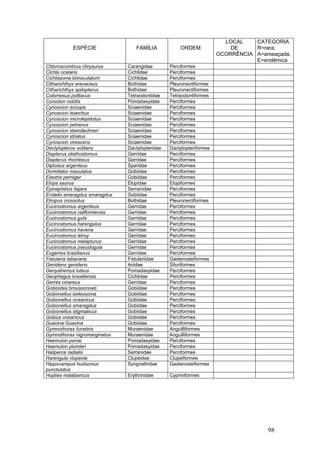
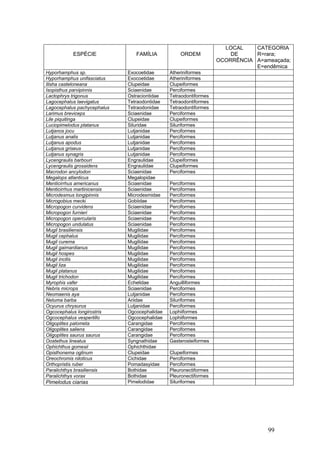
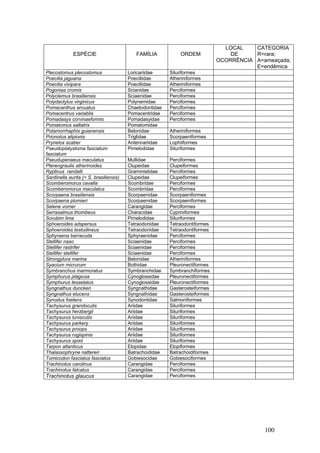
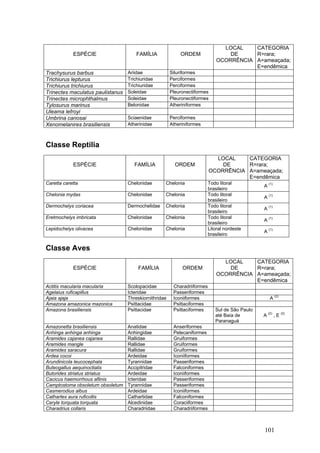
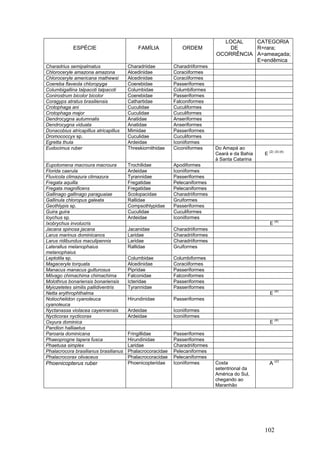
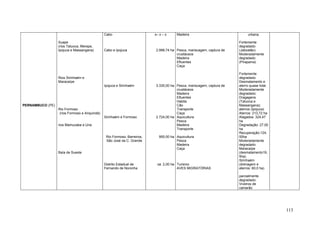
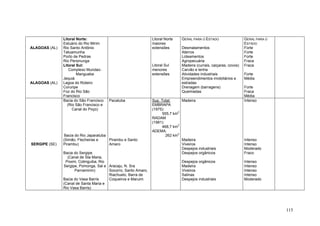
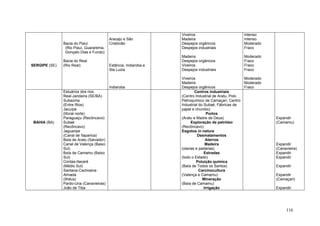
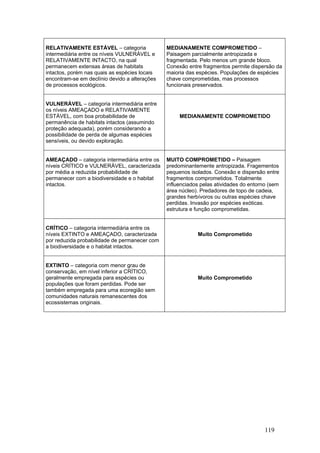
Este documento fornece um resumo da situação atual dos ecossistemas de manguezal, marisma e apicum ao longo do litoral brasileiro. Discute as principais unidades físico-ambientais destes ecossistemas, os vetores de pressão sobre eles, e fornece recomendações para a conservação e uso sustentável de sua biodiversidade. Inclui tabelas e listas de espécies associadas a estes ecossistemas, bem como um glossário de termos técnicos.