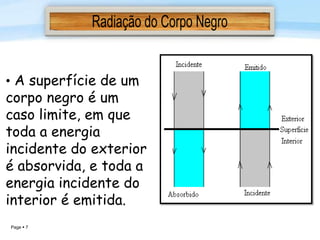
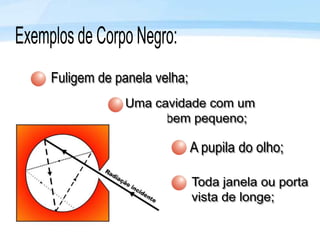
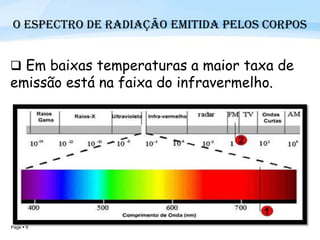
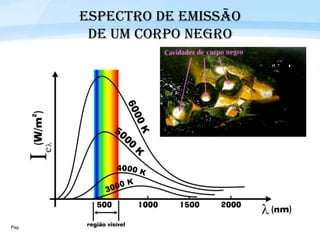
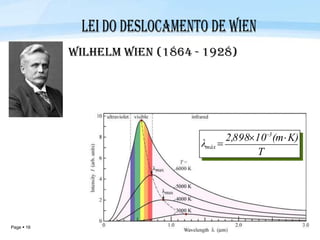
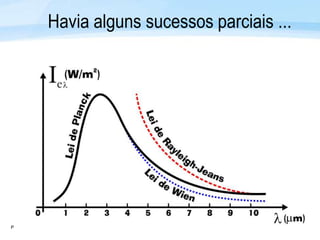
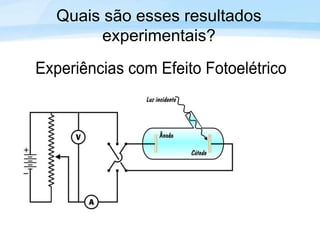
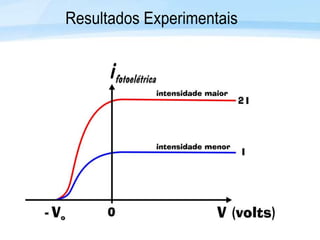
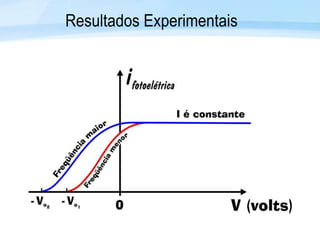
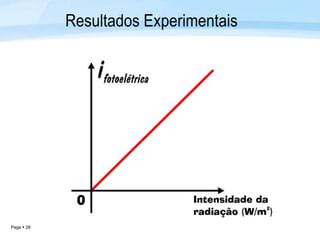
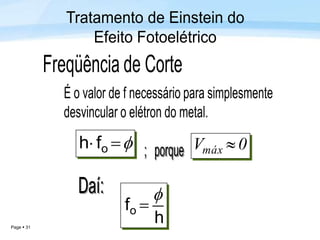
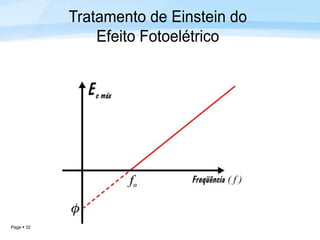
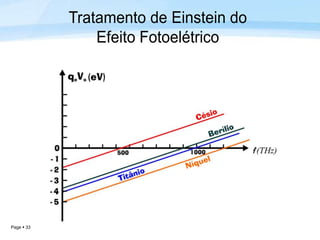
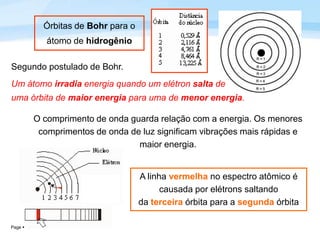
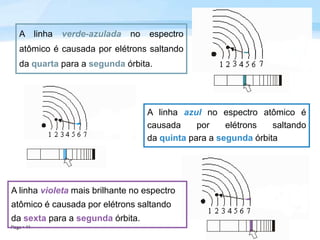
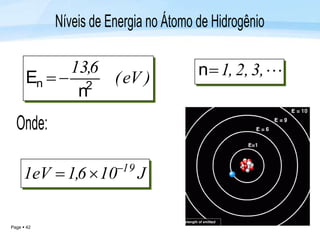
O documento discute a radiação térmica emitida por corpos e o modelo atômico de Bohr. Apresenta o corpo negro, cuja superfície absorve toda radiação incidente, e descreve como a radiação emitida depende da temperatura do corpo. Explica também que Bohr propôs um modelo atômico onde os elétrons orbitam em níveis de energia discretos, emitindo radiação quando pulam entre esses níveis.