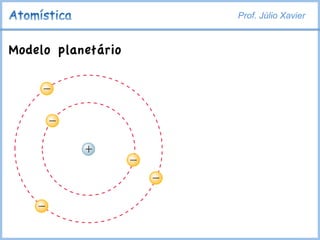
O documento discute o modelo atômico de Rutherford-Bohr, que explica a estrutura atômica com um núcleo denso de carga positiva ao redor do qual giram elétrons. O modelo resolvia paradoxos do modelo de Rutherford, como a estabilidade dos átomos, definindo que os elétrons podem orbitar apenas em camadas quantizadas de energia. Isso explicava as linhas discretas nos espectros atômicos.