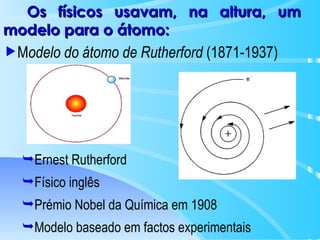
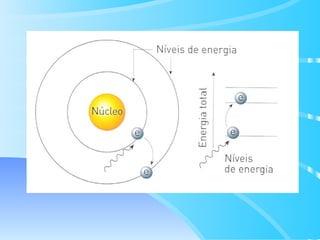
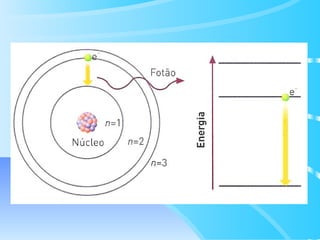
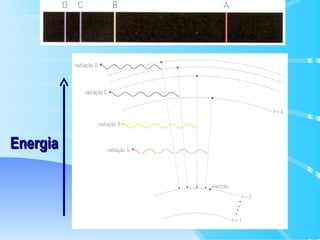
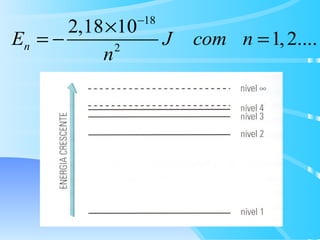
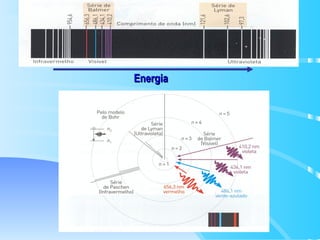
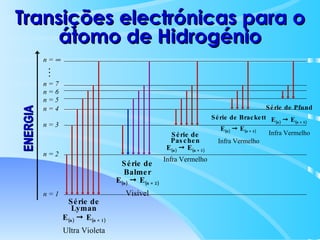
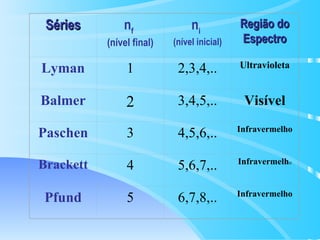
O documento descreve o modelo atômico de Bohr para o átomo de hidrogênio, que explica o espectro descontínuo do átomo. Bohr postulou que os elétrons estão restritos a órbitas definidas com energia quantizada e podem transitar entre níveis de energia, emitindo fótons. Cada série espectral, como Lyman e Balmer, corresponde a transições entre níveis específicos que emitem radiação em regiões do espectro.