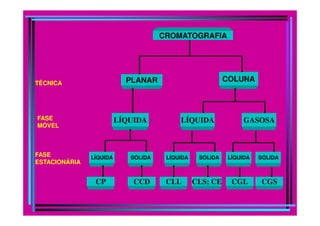
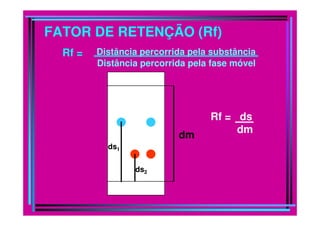
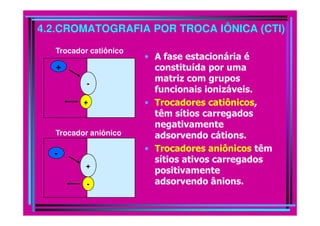
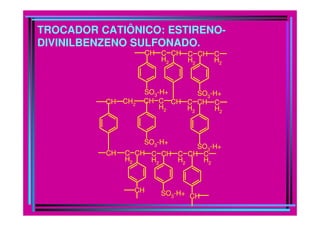
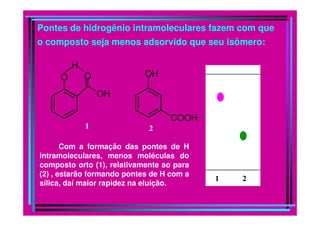
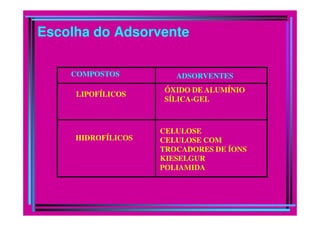
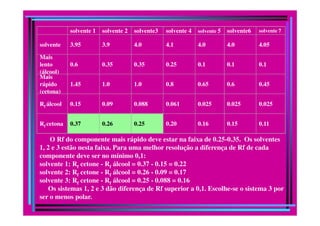
O documento descreve os princípios e métodos da cromatografia. A cromatografia é um método físico-químico de separação baseado na migração diferencial dos componentes de uma mistura devido a diferentes graus de interação entre duas fases imiscíveis, uma móvel e outra fixa. O documento classifica os diferentes tipos de cromatografia e descreve métodos como a cromatografia líquida, em coluna, em camada delgada e por exclusão.