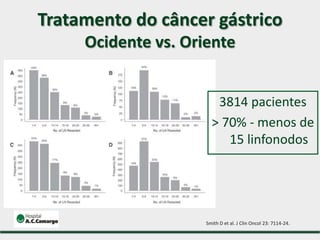
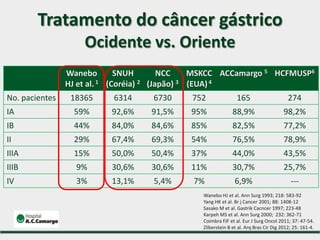
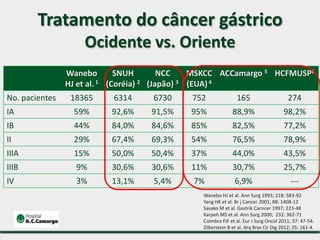
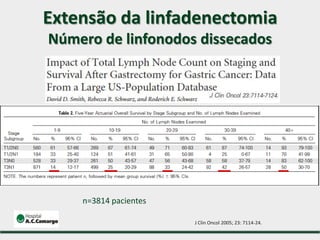
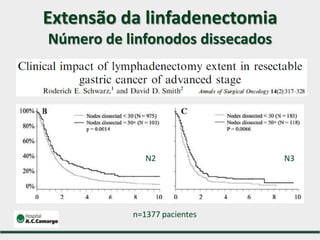
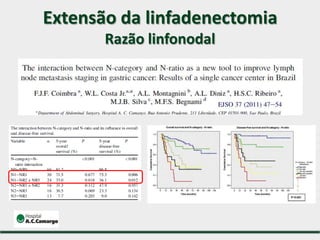
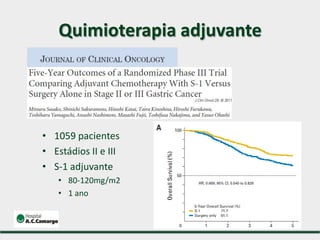
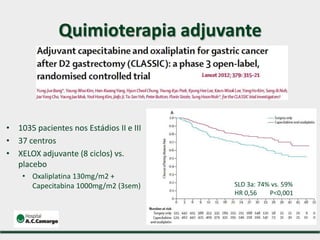
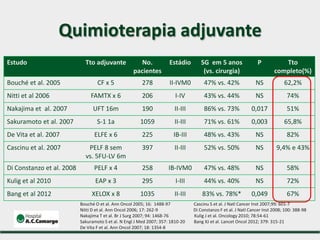
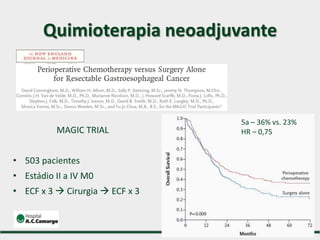
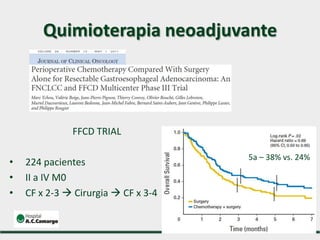
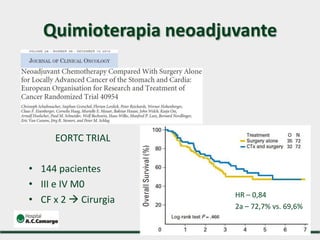
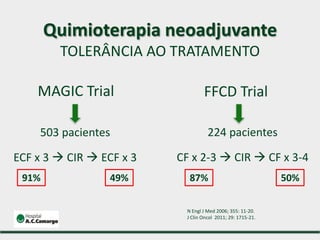
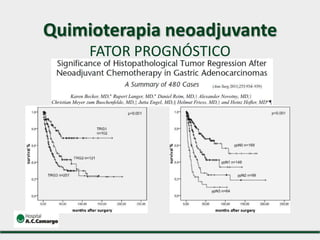
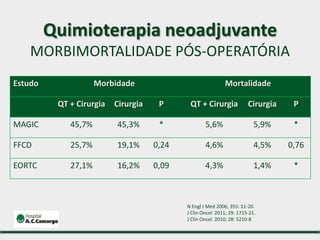
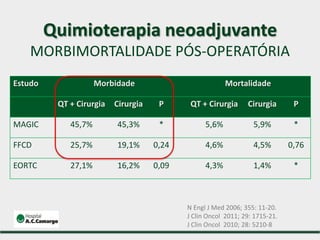
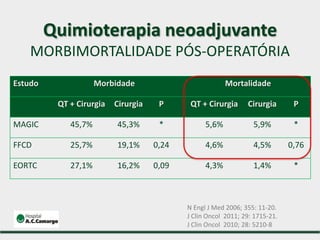
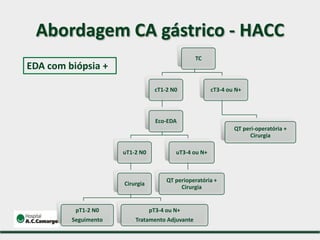
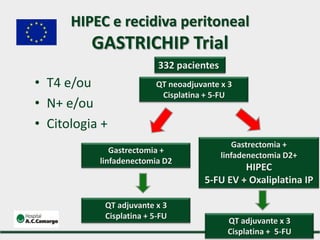
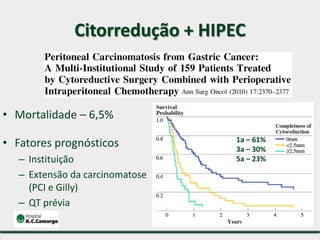
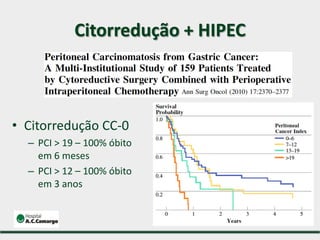
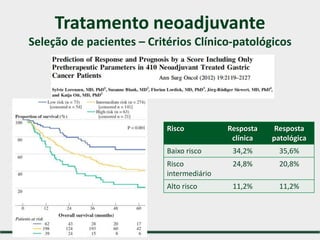
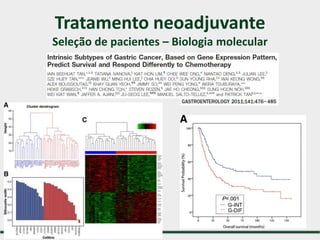
1) Discute o tratamento do câncer gástrico comparando o Ocidente e o Oriente, com taxas de sobrevivência mais altas no Oriente.
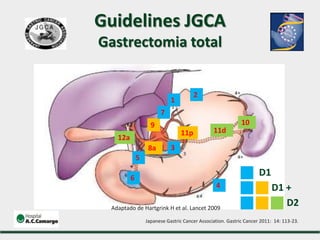
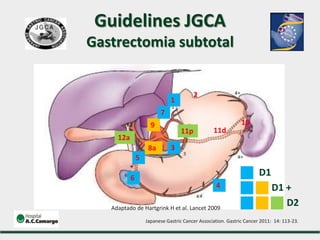
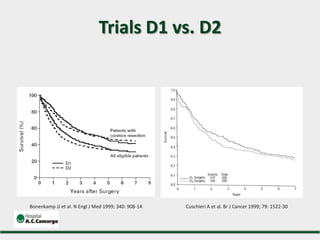
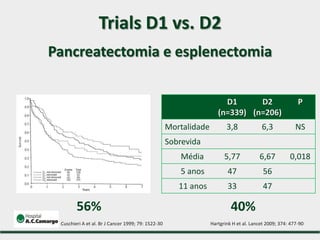
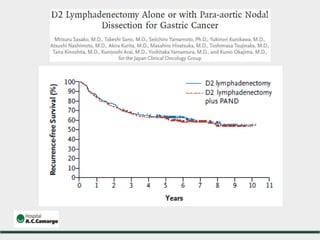
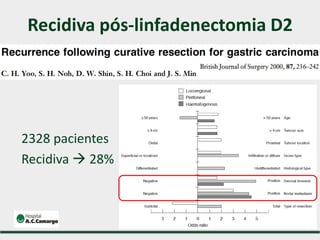
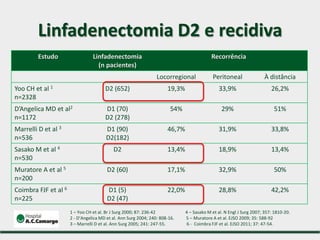
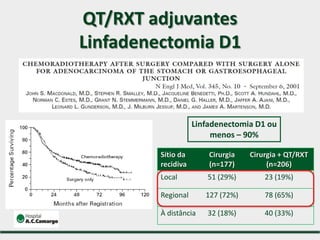
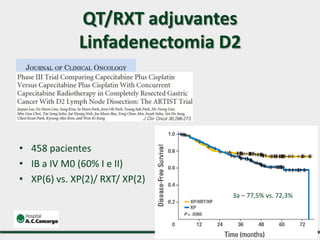
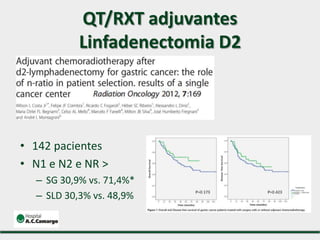
2) Apresenta dados sobre a controvérsia entre linfadenectomias D1 e D2, com estudos demonstrando benefícios da D2 em termos de sobrevida e recorrência local.
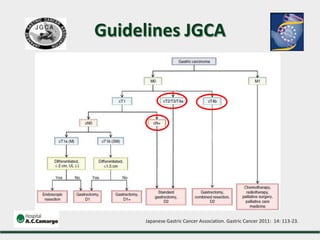
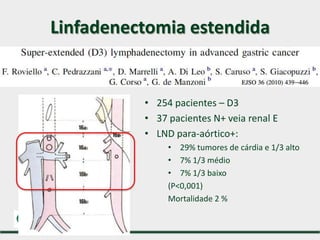
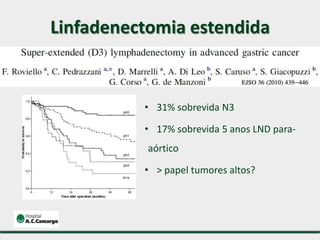
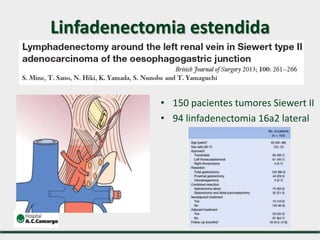
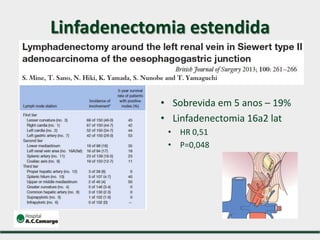
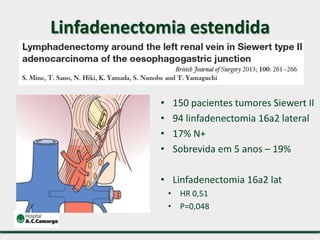
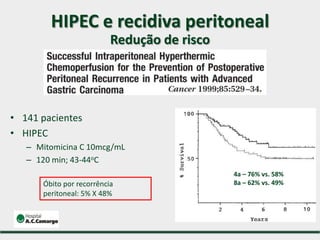
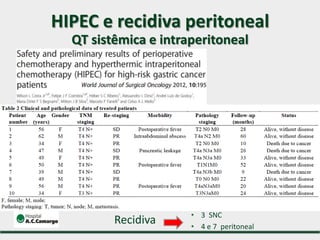
3) Discutem a importância da linfadenectomia estendida e seus benefícios, inclusive para tumores em regiões específicas.