1. O documento descreve como calcular a massa molar, quantidade de matéria, fração molar e fração mássica de substâncias químicas.
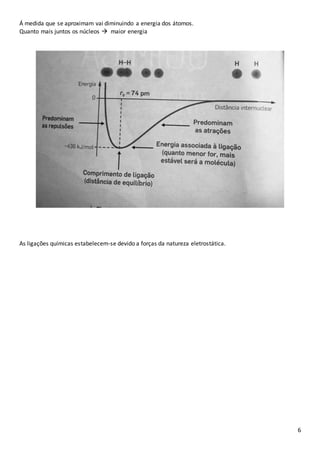
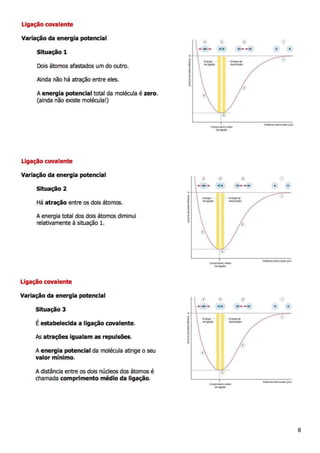
2. Apresenta os principais tipos de ligações químicas - covalentes, iônicas e metálicas - e como átomos se ligam para alcançar maior estabilidade energética.
3. Explica como escrever a ligação eletrônica de átomos e moléculas como H2, O2 e N2 usando a notação de Lewis.