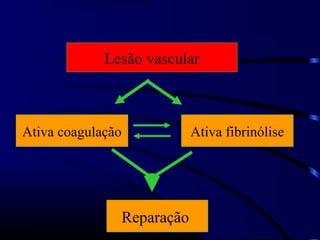
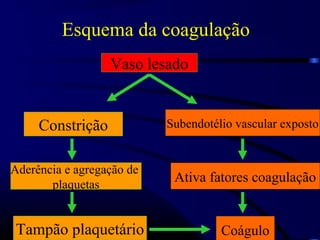
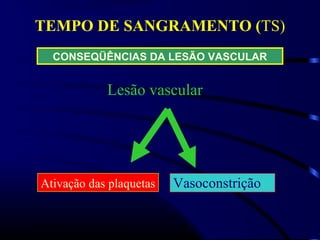
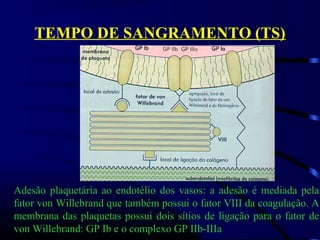
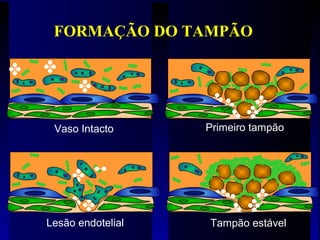
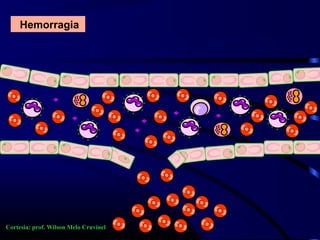
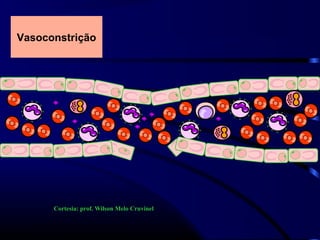
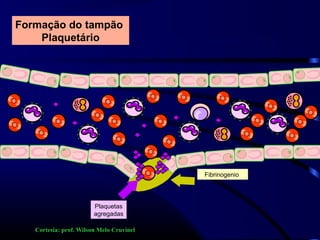
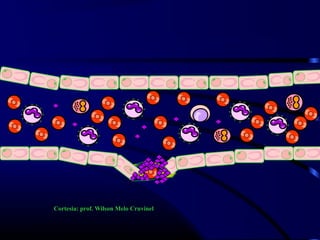
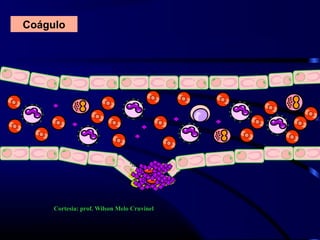
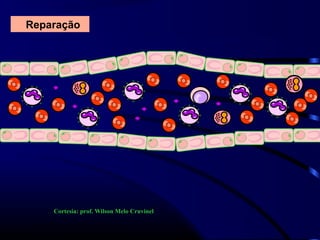
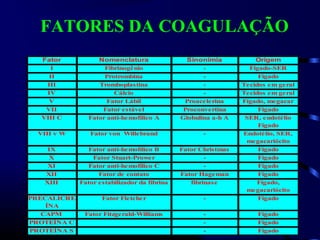
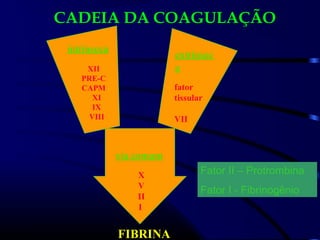
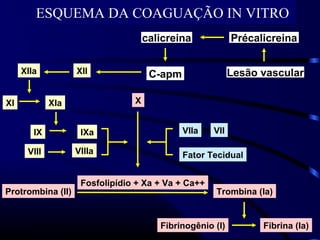
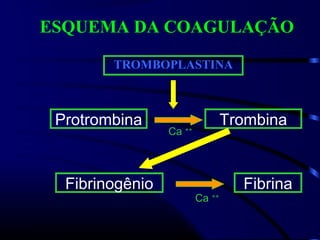
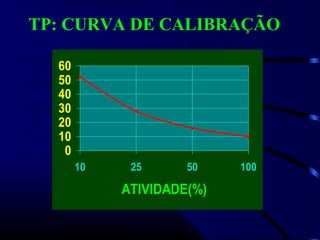
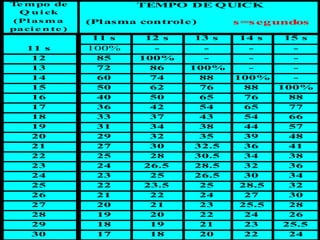
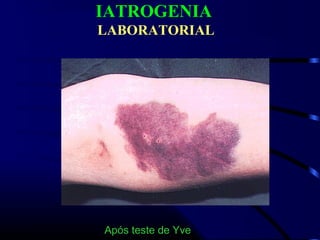
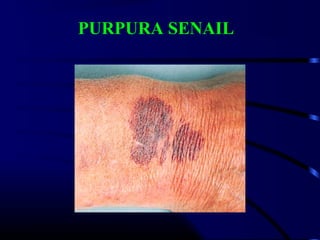
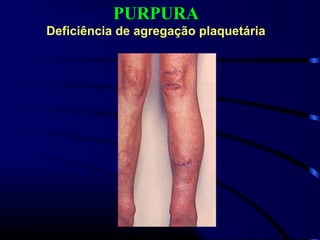
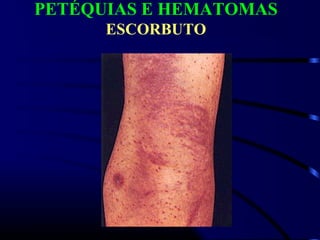
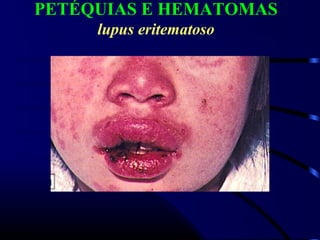
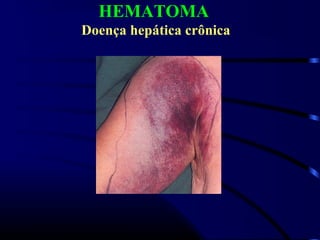
1) O documento descreve vários testes laboratoriais para avaliar a coagulação sanguínea, incluindo o Tempo de Sangramento, Tempo de Coagulação, Retração do Coágulo. 2) Estes testes medem fatores como o número e função de plaquetas, níveis de fatores de coagulação, e a capacidade do sangue de formar um coágulo estável. 3) Os resultados dos testes podem ajudar a diagnosticar problemas de coagulação como trombocitopenia ou hipercoagulação.