I. O documento discute processos físicos e químicos que ocorrem quando se eleva a temperatura de um sistema, especificamente a evaporação, decomposição e formação de compostos indesejáveis em medicamentos quando expostos ao calor.
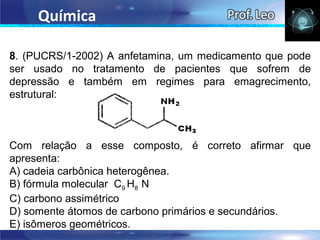
II. O documento também discute as propriedades do chumbo e identifica quais afirmações sobre ele são corretas.
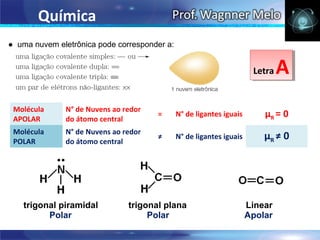
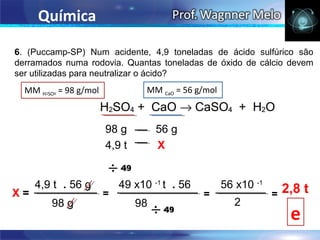
III. Por fim, o documento determina a geometria molecular e polaridade de compostos como amônia, metanal e dióxido de carbono.