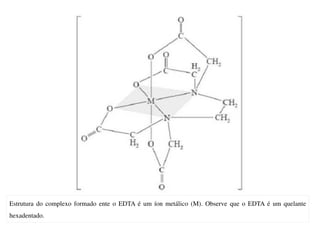
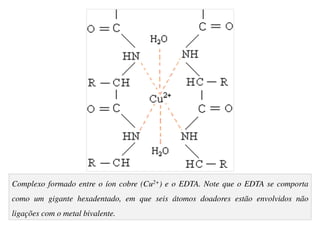
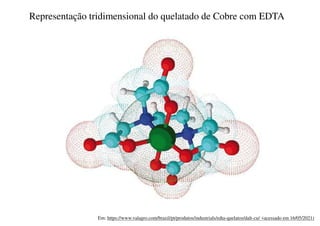
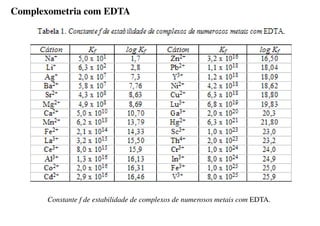
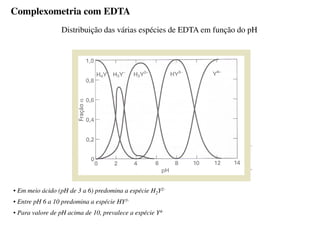
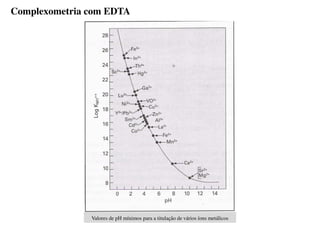
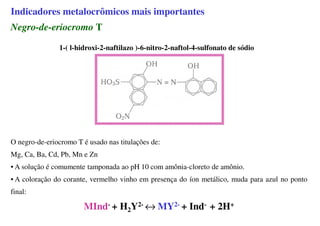
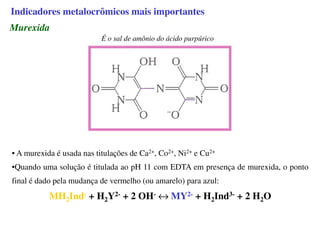
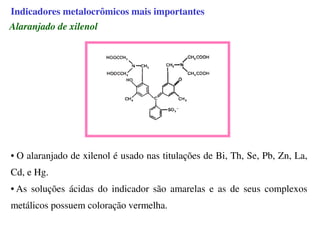
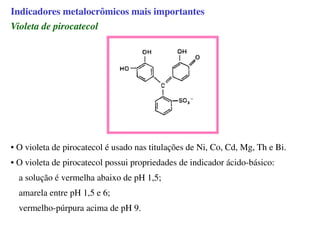
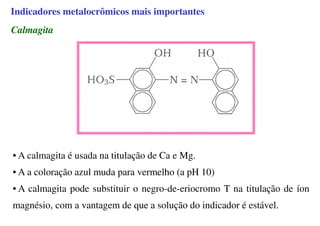
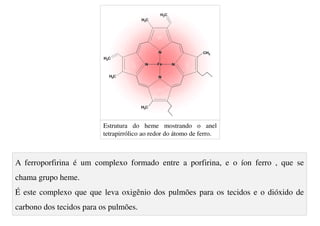
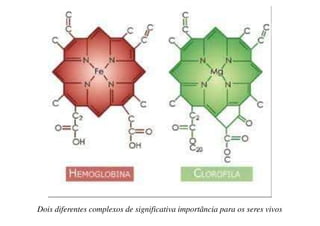
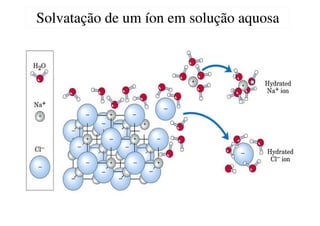
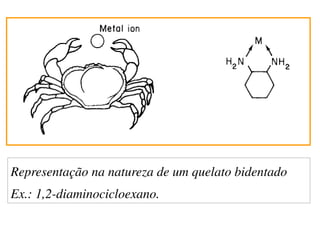
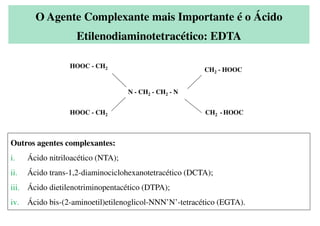
O documento aborda os complexos químicos, definindo-os como compostos com um cátion metálico central ligado a ligantes. Explora a formação de complexos, os tipos de ligantes, e a complexometria, especialmente o uso do ácido etilenodiaminotetracético (EDTA) como agente quelante. Destaca também suas aplicações em análises químicas e na medicina, ilustrando a importância da química de coordenação.













![Particularidade: os valores das sucessivas constantes de
formação dos complexos metálicos são, via de regra, muito
mais aproximados entre si do que os das sucessivas constantes
de dissociação dos ácidos polipróticos.
A formação de um complexo metálico mononucIear
pode ser genericamente representada pela equação
M + nL ↔ MLn
Kf =
[MLn]
[M] x [L]n
Constantes de formação dos complexos](https://image.slidesharecdn.com/equilibrioetitulometriadecomplexacao-240506014731-04a36702/85/Equilibrio-e-Titulometria-de-Complexacao-pdf-23-320.jpg)


![Complexometria
A titulometria com formação de complexos ou complexometria
baseia-se em reações que envolvem um íon metálico M e um
agente ligante L com formação de um complexo
suficientemente estável.
O caso mais simples é o de uma reação que origina um
complexo do tipo 1 para 1:
M + L ↔ ML
Kf =
[ML]
[M] x [L]](https://image.slidesharecdn.com/equilibrioetitulometriadecomplexacao-240506014731-04a36702/85/Equilibrio-e-Titulometria-de-Complexacao-pdf-26-320.jpg)
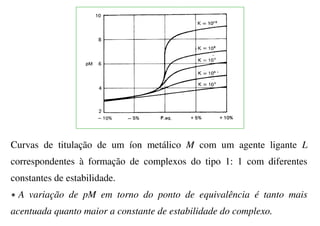
![Curva de Titulação Complexométrica
pM = - log [M]
(função da quantidade de complexante adicionada)
pM = log Kf + log ([L]/[ML])
No ponto de equivalência [M]eq = [L]eq e [ML]eq ≈ CM
∴
[M]eq = ([ML]eq / Kf)1/2 ≈ (CM /Kf)1/2](https://image.slidesharecdn.com/equilibrioetitulometriadecomplexacao-240506014731-04a36702/85/Equilibrio-e-Titulometria-de-Complexacao-pdf-27-320.jpg)





![• Titulação de cianeto com nitrato de prata
A titulação de íon cianeto com nitrato de prata (método de Liebig) baseia-
se na formação de um íon complexo muito estável, o íon dicianoargentato:
2 CN- + Ag+ ↔ Ag(CN)2
-
A constante de estabilidade é: Kf = 1 x 1021
Indicação do ponto final da titulação:
4O ponto final é sinalizado pelo aparecimento de uma turvação branca
devido à formação de dicianoargentato de prata: Ag[Ag(CN)2]](https://image.slidesharecdn.com/equilibrioetitulometriadecomplexacao-240506014731-04a36702/85/Equilibrio-e-Titulometria-de-Complexacao-pdf-35-320.jpg)