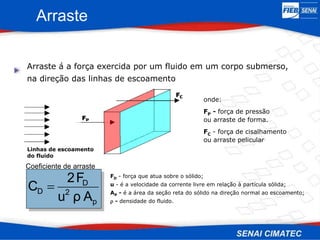
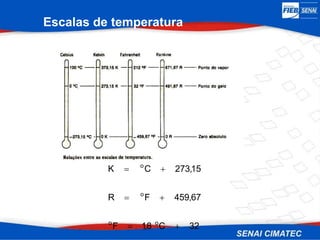
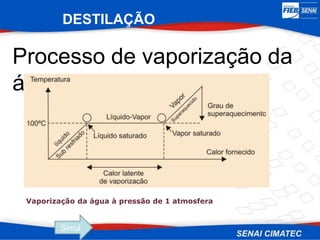
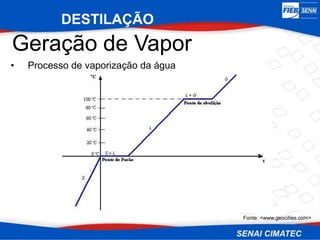
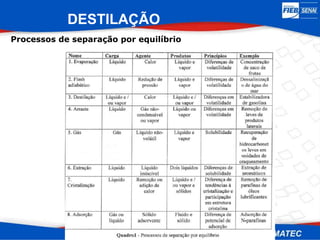
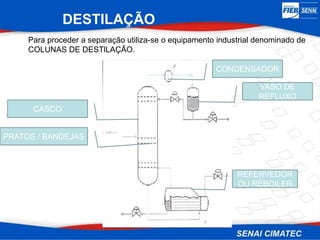
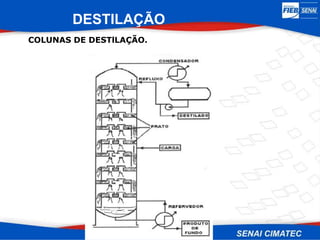
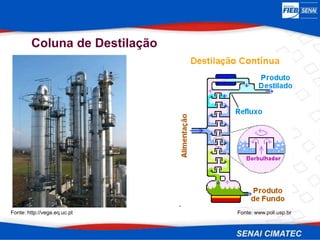
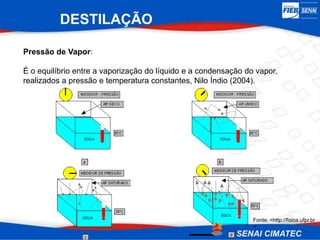
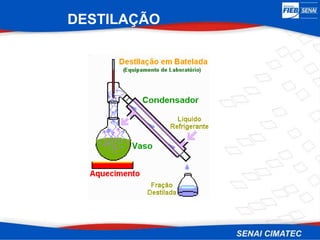
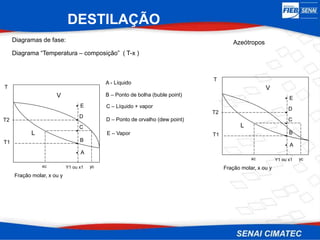
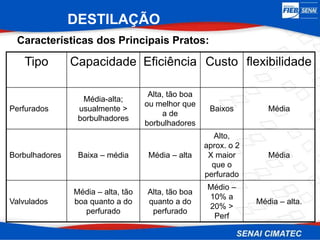
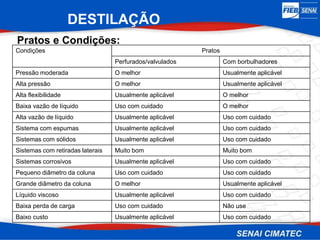
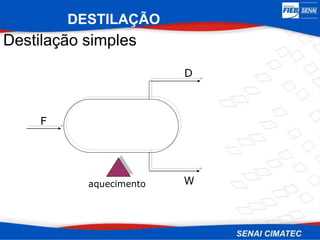
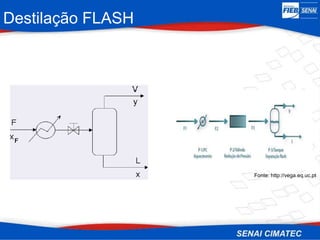
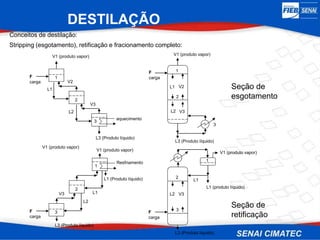
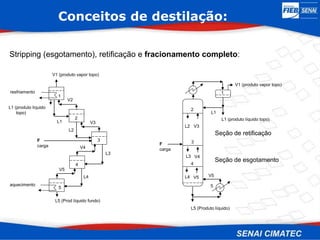
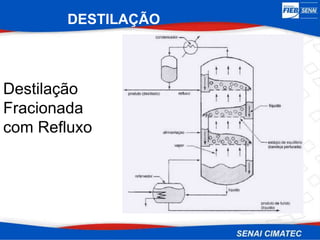
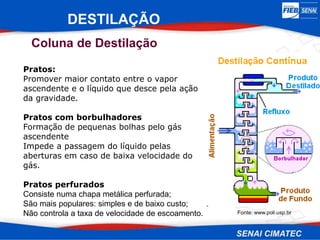
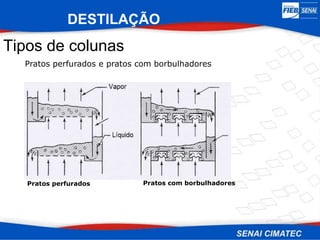
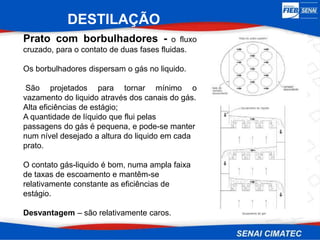
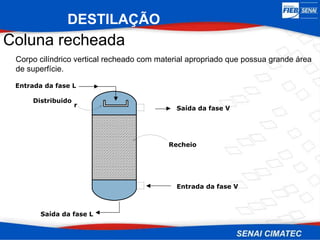
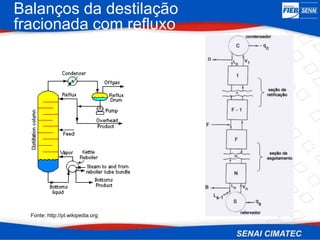
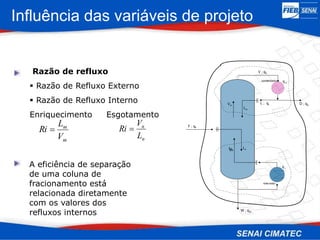
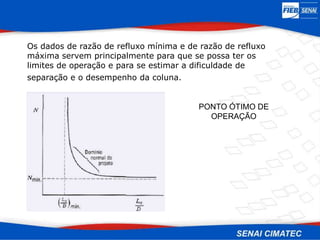
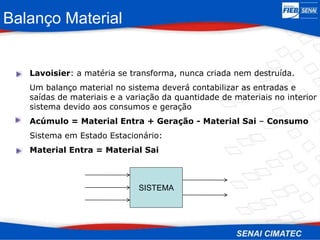
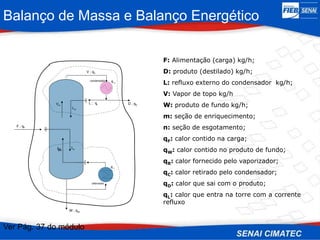
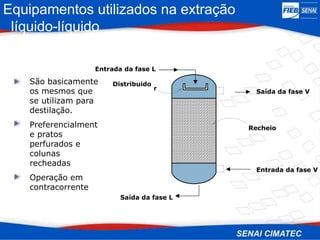
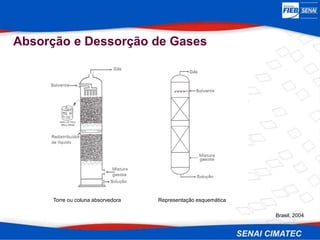
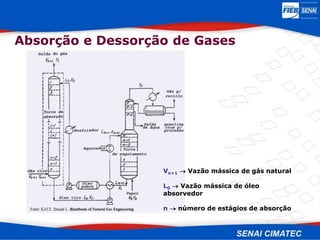
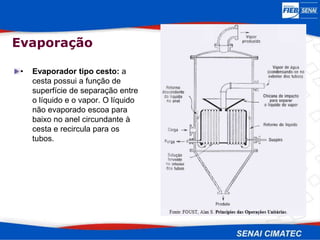
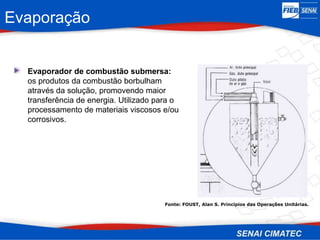
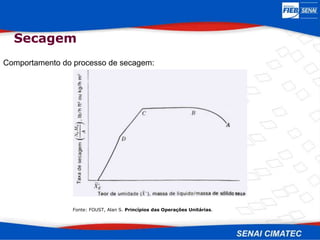
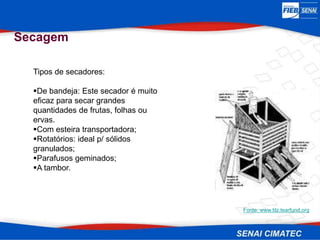
O documento apresenta uma visão geral sobre destilação e operações unitárias, abordando conceitos fundamentais e a classificação de métodos de separação. A destilação é destacada como o processo mais utilizado na indústria química, baseado nas diferenças de volatilidade e pontos de ebulição das substâncias. O texto também discute a importância do equilíbrio líquido-vapor e os tipos de escoamento, além de fornecer uma análise detalhada de propriedades como entalpia, calor específico e arraste.