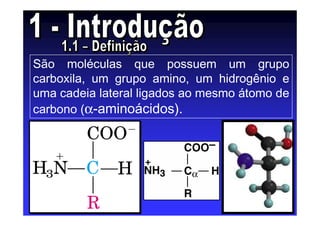
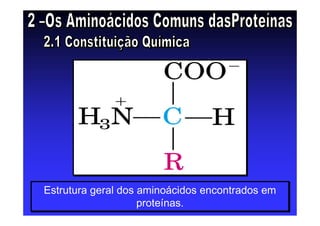
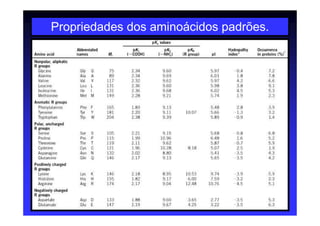
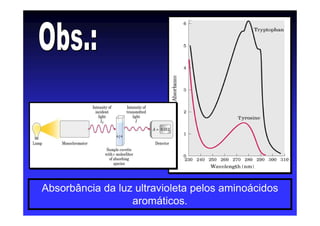
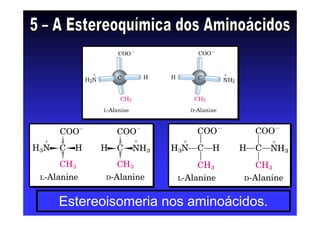
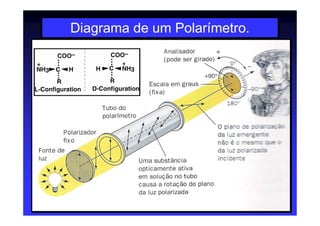
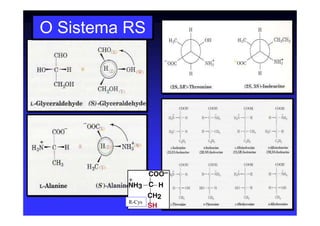
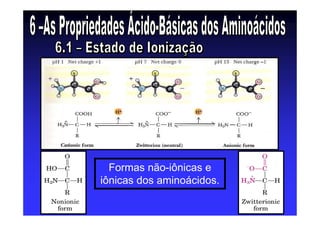
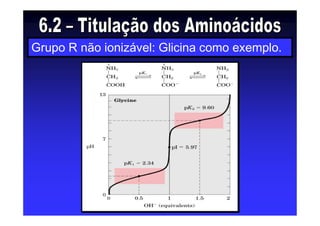
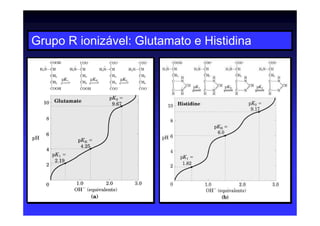
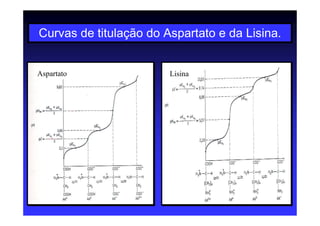
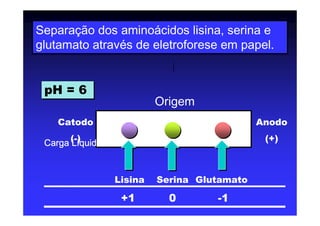
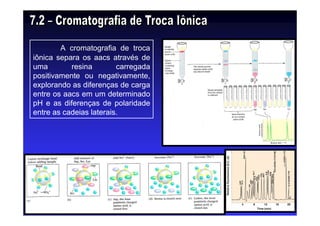
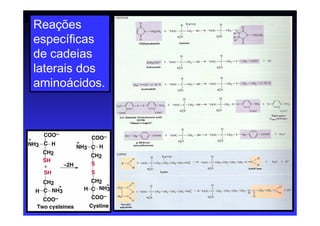
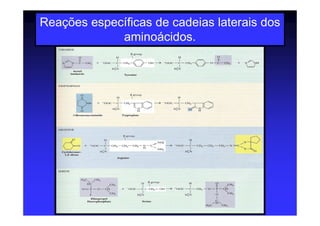
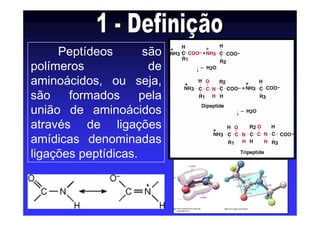
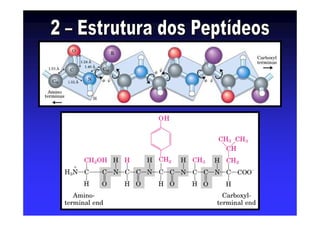
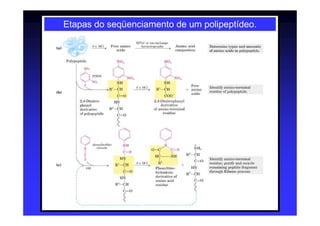
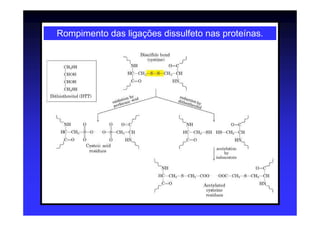
Os aminoácidos são moléculas orgânicas que possuem grupos carboxila, amino e cadeia lateral ligados ao mesmo átomo de carbono. São os blocos construtivos das proteínas e precursores de várias biomoléculas importantes. O documento descreve a estrutura e propriedades dos 20 aminoácidos primários encontrados em proteínas, além de métodos como eletroforese e cromatografia para separá-los.