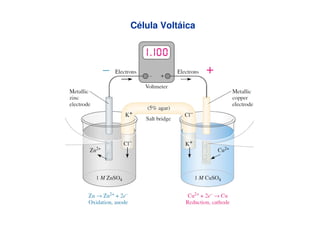
Este documento discute equações e conceitos importantes relacionados a pilhas, incluindo a equação de Nernst para determinar potenciais em condições não-padrão, experimentos para determinar valores de potencial padrão e concentrações iônicas, e o funcionamento de pilhas de concentração.



![x
y
Ox
d
n
EE
][
][Re
log
059,00
−=
Semi-Reação de Redução
Fe3+ + é →→→→ Fe2+ (E0= -0,771 V)
][
][
log
1
059,0
771,0 2
3
+
+
−−=
Fe
Fe
E](https://image.slidesharecdn.com/eqnernstexp-130804184903-phpapp01/85/Eq-nernst-exp-7-320.jpg)
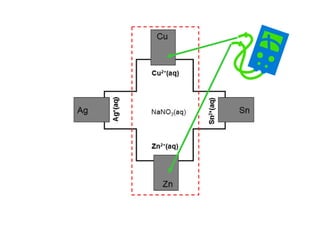
![Experimento:
-Determinação de E0
-Determinação de [X]
-Determinação de K](https://image.slidesharecdn.com/eqnernstexp-130804184903-phpapp01/85/Eq-nernst-exp-8-320.jpg)
![Determinação de E0
Cu2+ + Zn → Cu + Zn2+
][
][
log
2
059,0
2
2
0
+
+
−=
Cu
Zn
EE
Condição inicial: [Zn2+] = [Cu2+] = 0,1 M
]1,0[
]1,0[
log
2
059,00
−= EE
1log
2
059,00
−= EE E = E0](https://image.slidesharecdn.com/eqnernstexp-130804184903-phpapp01/85/Eq-nernst-exp-9-320.jpg)
![Condição inicial: [Zn2+] = [Cu2+] = 0,1 M
]1,0[
]1,0[
log
2
059,00
−= EE
1log
2
059,00
−= EE E = E0](https://image.slidesharecdn.com/eqnernstexp-130804184903-phpapp01/85/Eq-nernst-exp-10-320.jpg)
![[Ag+]= 0,1 M [Ag+]= ?
AgCl Ag+ + Cl-](https://image.slidesharecdn.com/eqnernstexp-130804184903-phpapp01/85/Eq-nernst-exp-11-320.jpg)
![Determinação Concentração
AgCl ⇌ Ag+ + Cl-
2 Ag+ + Zn 2Ag0 + Zn2+
2
2
0
][
][
log
2
059,0
+
+
−=
Ag
Zn
EE](https://image.slidesharecdn.com/eqnernstexp-130804184903-phpapp01/85/Eq-nernst-exp-12-320.jpg)
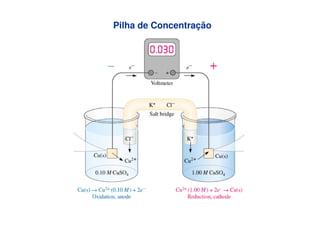
![Ag+ + é Ag0
Pilha de Concentração
][
][
log
1
059,0
aConcentradAg
DiluídaAg
E +
+
−=](https://image.slidesharecdn.com/eqnernstexp-130804184903-phpapp01/85/Eq-nernst-exp-13-320.jpg)