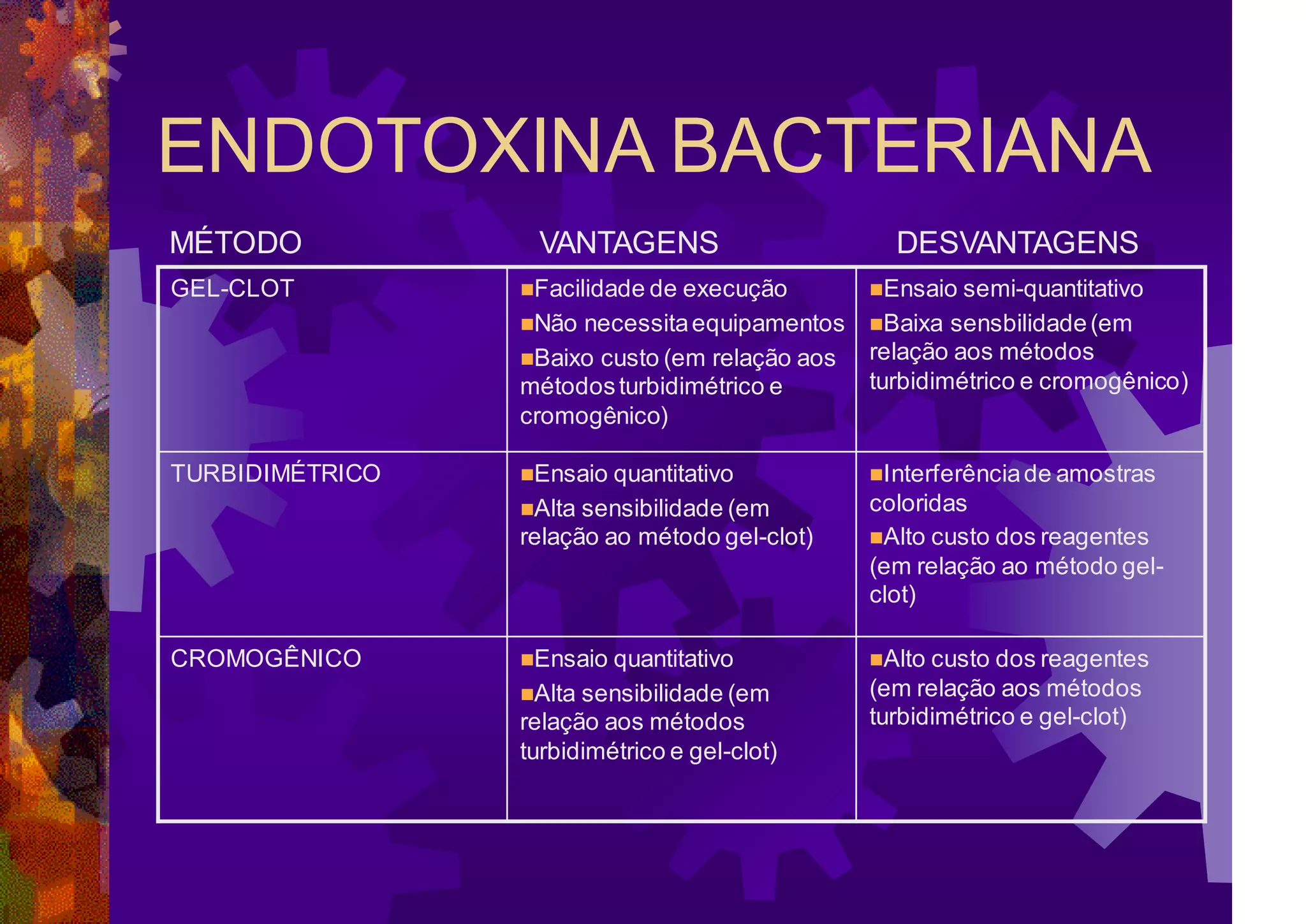
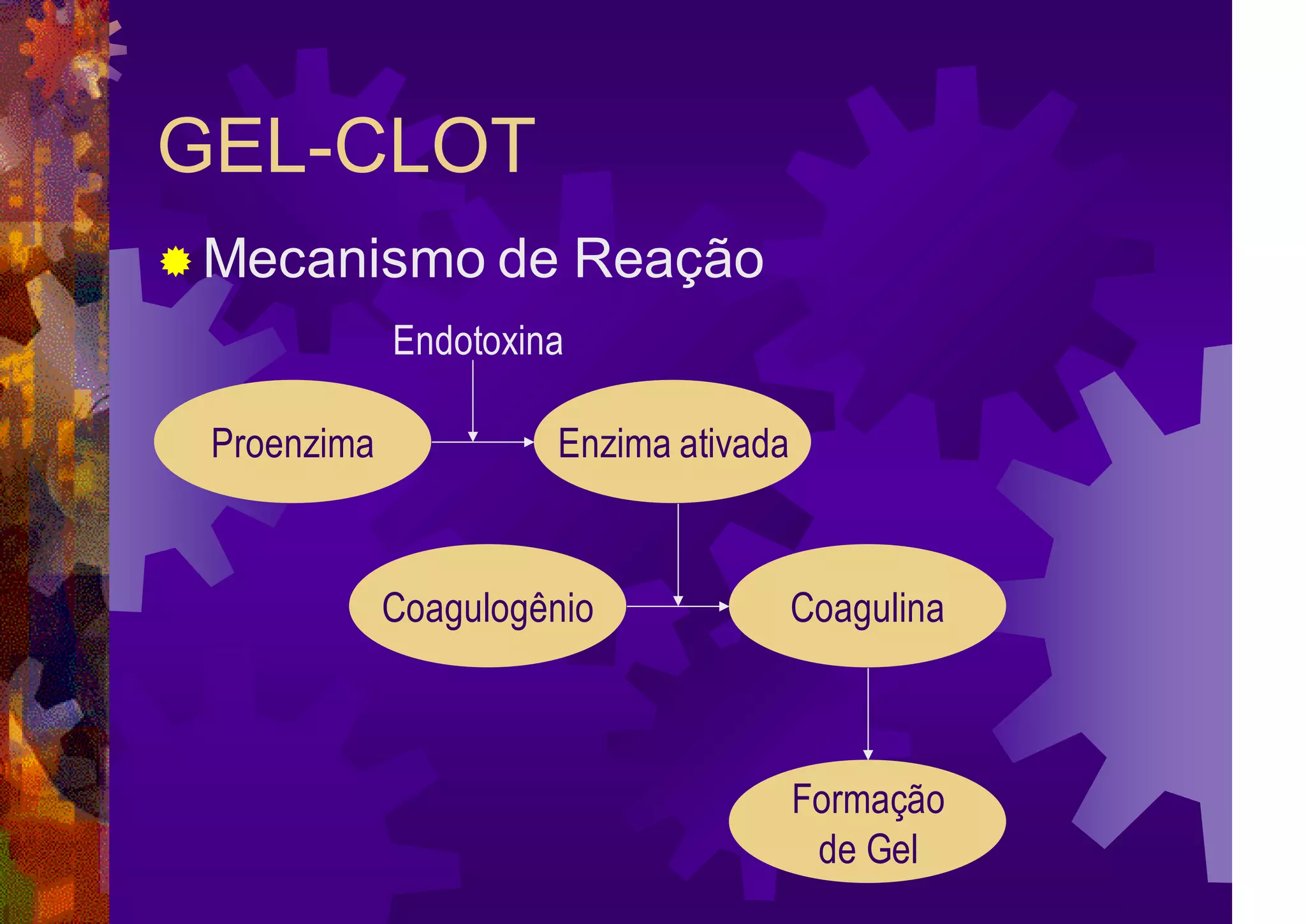
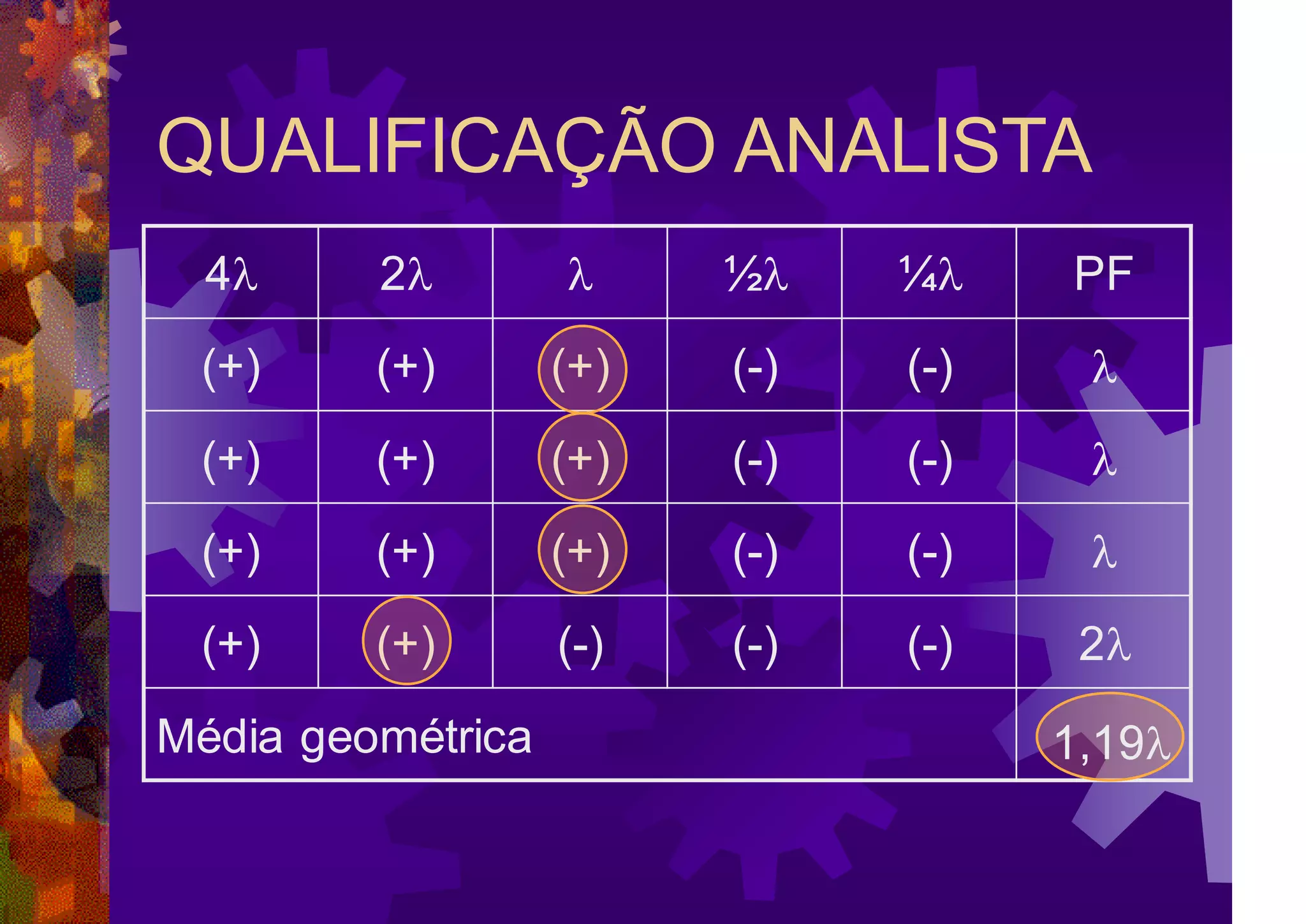
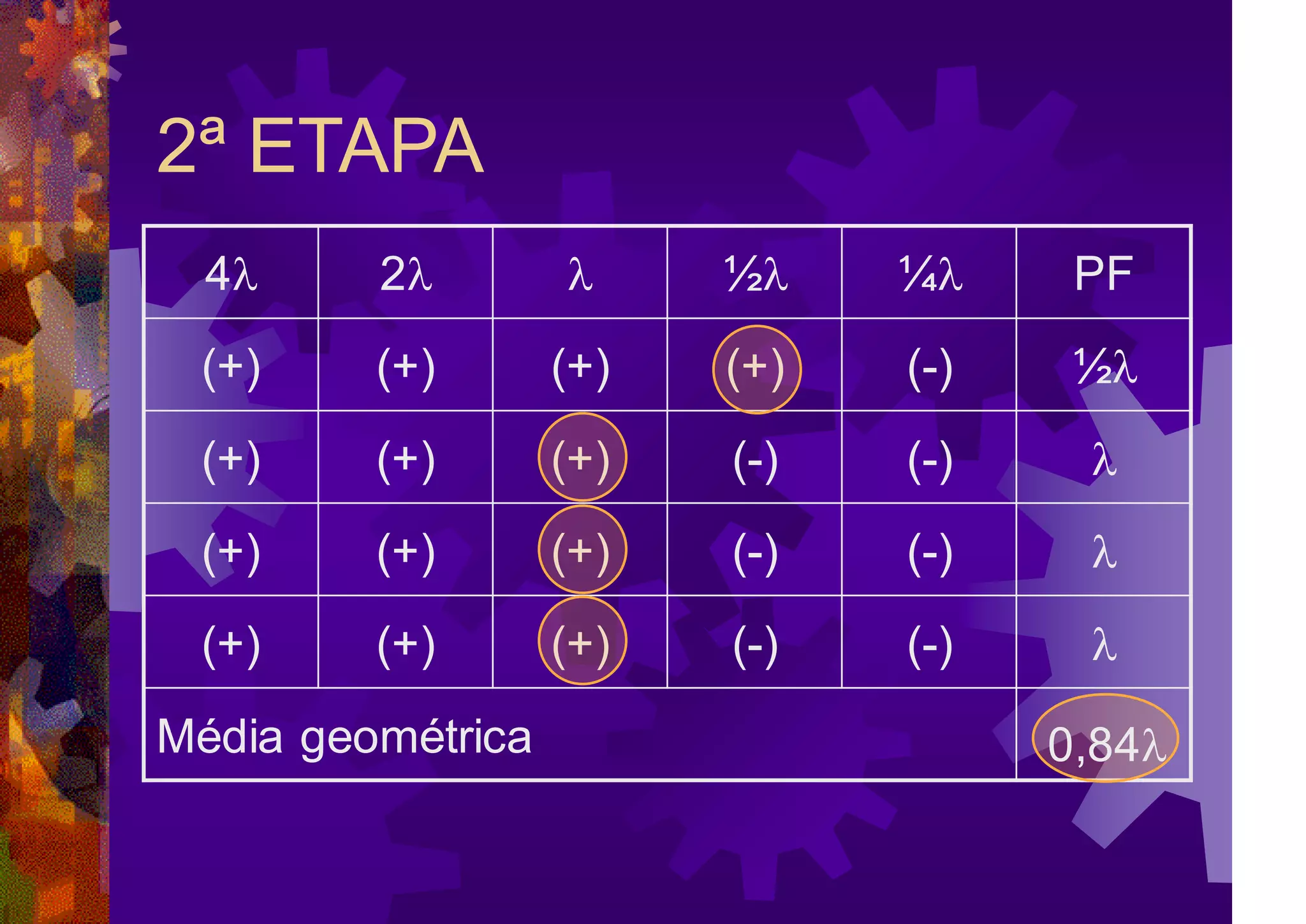
O documento resume a história e os métodos de detecção e quantificação de endotoxinas bacterianas. Aborda os principais conceitos, como pirogênio, estrutura do LPS e fontes de pirogênio. Descreve os métodos in vivo e in vitro, destacando o teste de gelificação, os métodos cromogênicos e turbidimétricos.










































![CROMOGÊNICO END-POINT
[pNA] (A)
Tempo (min)](https://image.slidesharecdn.com/pirognioeendotoxina2019-230805202642-6632144e/75/Pirogenio-e-Endotoxina_2019-pdf-46-2048.jpg)
![CROMOGÊNICO END-POINT
pNA (A)
Log[LPS]](https://image.slidesharecdn.com/pirognioeendotoxina2019-230805202642-6632144e/75/Pirogenio-e-Endotoxina_2019-pdf-47-2048.jpg)


![CROMOGÊNICO KINETIC
pNA (A)
Log[LPS]](https://image.slidesharecdn.com/pirognioeendotoxina2019-230805202642-6632144e/75/Pirogenio-e-Endotoxina_2019-pdf-50-2048.jpg)



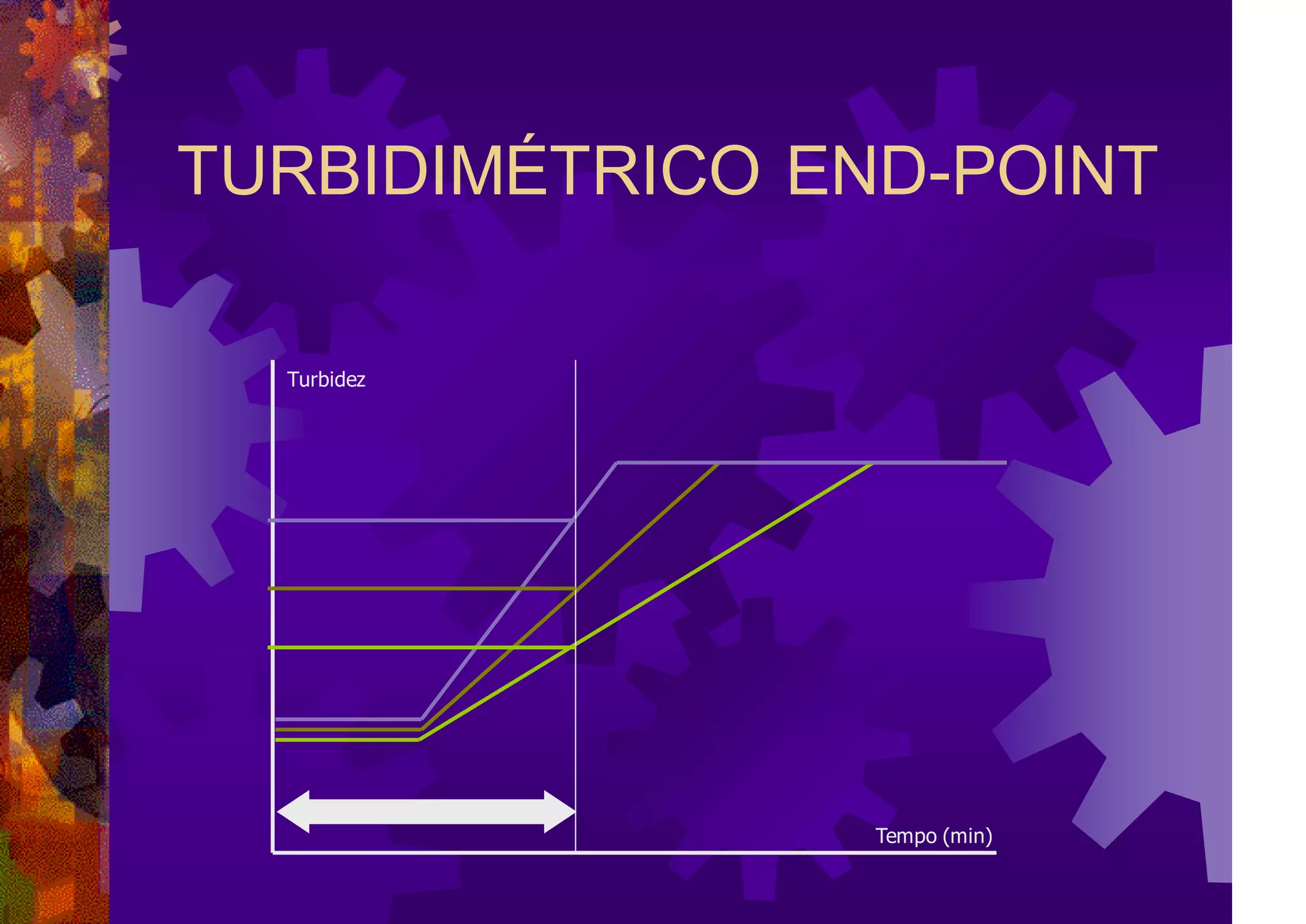
![Turbidez
Log[LPS]
TURBIDIMÉTRICO END-POINT](https://image.slidesharecdn.com/pirognioeendotoxina2019-230805202642-6632144e/75/Pirogenio-e-Endotoxina_2019-pdf-55-2048.jpg)


![Turbidez
Log[LPS]
TURBIDIMÉTRICO KINETIC](https://image.slidesharecdn.com/pirognioeendotoxina2019-230805202642-6632144e/75/Pirogenio-e-Endotoxina_2019-pdf-58-2048.jpg)