1) O documento discute conceitos importantes para a qualidade da água e do solo em sistemas de piscicultura, incluindo a densidade do solo, porosidade, textura, cor, estrutura, nutrientes como nitrogênio e fósforo.
2) É fornecido detalhes sobre métodos para determinar a densidade real, densidade aparente e porosidade do solo, os quais fornecem informações úteis sobre o manejo do solo e construção de viveiros.
3) Fatores ambientais como temperatura, oxigênio

























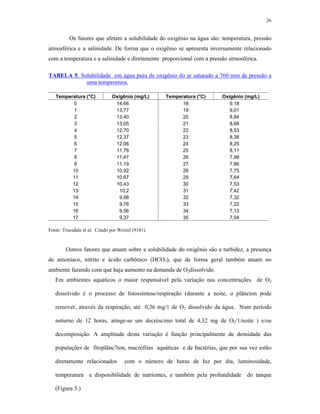






















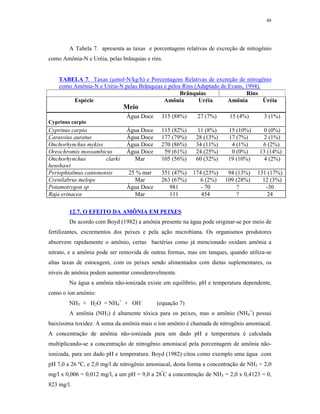







![32
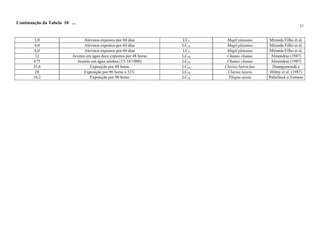
Ultra-oligotrófico <5
Oligomesotrófico 5 - 10
Meso-eutrófico 10 - 30
Eu-politrófico 30 - 100
Politrófico >100
Fonte: Adaptado de ESTEVES (1998)
14.3. CICLOS DO FÓSFORO
Vários fatores interferem na precipitação do íon fosfato no ambiente aquático, dentre
eles podem ser destacados as concentrações de íons ferro (solos argilosos), alumínio (solos
arenosos), sulfetos orgânicos e carbonatos, o pH e condições de oxidoredução (ESTEVES,
1998 e WELCH, 1992).
O ferro é o íon mais importante na precipitação do fosfato, a dinâmica de ação dos íons
de ferro sobre o fosfato depende do seu estado de oxidação e do pH do meio. Em condições
menos ácidas, como a maioria das águas continentais, a maior parte do íon férrico encontra-se
+3
complexado na forma de hidróxido de ferro hidratado (Fe + 6H20 [Fe6H2O]3+ [Fe(OH)
5H2O]2+ + H+), em sua superfície e precipitando-as principalmente no sedimento (ESTEVES,
1998).
Na água com altas concentrações de Ca e pH elevado, pode formar fosfato de cálcio, que
se precipita no sedimento podendo ser perdido do sistema. Outros dois elementos ligados ao
ciclo do fósforo na água são o ferro e o alumínio.
Os seres vivos, que vivem na coluna d’água têm um papel importante na dinâmica do
fosfato na coluna d’água, o fitoplâncton, o zooplâncton, as macrófitas, as bactérias,
protozoários e os peixes são constituintes desta população, e suas interações são responsáveis
pela manutenção de uma concentração de fosfato inorgânico na coluna d’água, principalmente
no epilimínio (ESTEVES, 1998).](https://image.slidesharecdn.com/livrogua2011-121128062046-phpapp02/85/Livro-agua-2011-63-320.jpg)