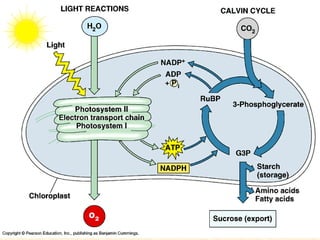
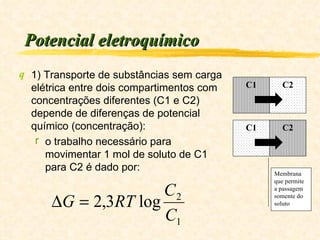
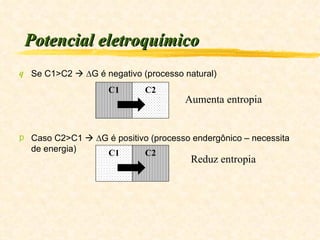
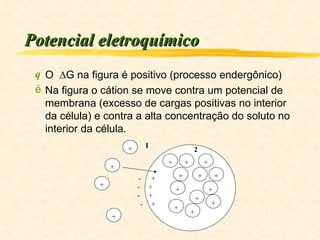
1) O documento discute os conceitos de energia, trabalho, calor e a Primeira Lei da Termodinâmica.
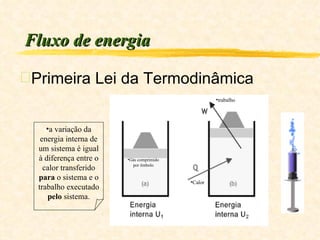
2) Explica que a variação da energia interna de um sistema é igual à diferença entre o calor transferido para o sistema e o trabalho executado pelo sistema.
3) Discutem-se os conceitos de sistema, meio externo e tipos de sistemas (fechado, aberto e isolado).