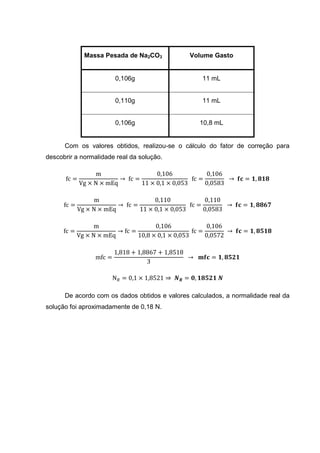
O documento descreve um experimento realizado por alunos de um curso técnico para determinar os níveis de sódio e potássio em amostras de cinzas. O processo envolveu a padronização de uma solução de HCl e a titulação das amostras de cinzas com essa solução. Os resultados mostraram que a concentração de álcalis nas amostras era de aproximadamente 8,66%.