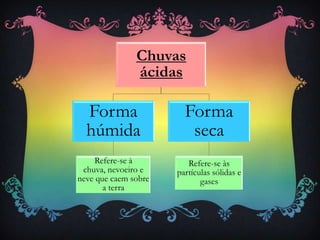
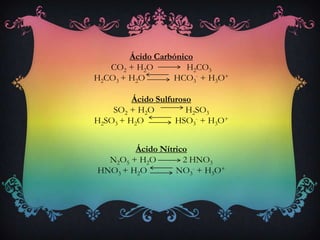
Chuva ácida é precipitação com pH menor que 5, formada quando óxidos de enxofre e azoto reagem com água, produzindo ácidos sulfúrico e nítrico. Isto causa danos à saúde, meio ambiente e estruturas. Reduzir emissões industriais e de veículos pode ajudar a diminuir o problema.