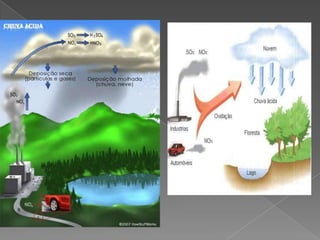
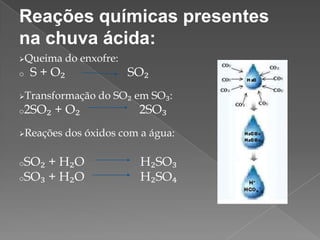
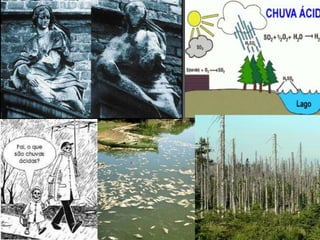
O documento discute o que é chuva ácida, suas causas e consequências. A chuva ácida ocorre quando gases como óxido de enxofre e óxido de nitrogênio reagem com a água, tornando a chuva mais ácida. Isso pode danificar ecossistemas, monumentos e afetar a saúde humana. Medidas como uso de transporte público e fontes de energia limpa podem ajudar a prevenir a chuva ácida.