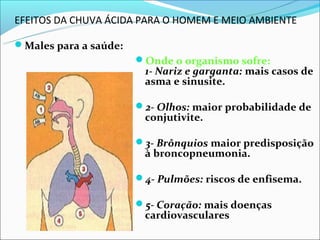
O documento discute o fenômeno da chuva ácida, explicando que quanto menor o pH maior a acidez. Apresenta valores típicos de pH e seus efeitos na fauna aquática. Descreve as reações químicas envolvidas na formação de chuva ácida por poluição atmosférica e seus impactos na saúde humana e meio ambiente, incluindo a destruição de florestas e lagos. Por fim, sugere medidas para evitar a poluição e consequentemente a chuva ácida, como uso