Aula completa sobre Água, Ácidos, Bases e Tampões
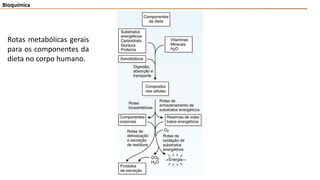
- 1. Bioquímica Rotas metabólicas gerais para os componentes da dieta no corpo humano.
- 2. Água, Ácidos, Bases e Tampões Bioquímica
- 4. Bioquímica
- 5. Bioquímica
- 6. Bioquímica funções da água no corpo os sistemas tampão utilizados pelo corpo para se proteger dos ácidos e bases produzidos no metabolismo
- 7. ÁGUA A água é distribuída entre os compartimentos intra e extracelulares; esse último inclui os líquidos intersticiais, o sangue e a linfa. Por ser a água uma molécula dipolar com uma distribuição irregular de elétrons entre os átomos de hidrogênio e oxigênio, ela forma ligações de hidrogênio com outras moléculas polares e age como um solvente. Bioquímica
- 8. O pH DA ÁGUA A água se dissocia fracamente para formar íons hidrogênio (H+) e hidroxil (OH-). A concentração de íons hidrogênio determina a acidez da solução, a qual é expressa em termos de pH. O pH de uma solução é o logaritmo negativo de sua concentração de íon hidrogênio. Bioquímica
- 9. ÁCIDOS E BASES Um ácido é uma substância que pode liberar íons hidrogênio, e uma base é uma substância que pode receber íons hidrogênio. Quase todas as moléculas de um ácido forte, quando dissolvidas em água, dissociam-se e liberam seus íons hidrogênio, mas apenas uma pequena porcentagem do total de moléculas de um ácido fraco se dissocia. Um ácido fraco tem uma constante de dissociação característica, Ka. A relação entre o pH de uma solução, o Ka de um ácido e a extensão de sua dissociação são obtidos pela equação de Henderson-Hasselbalch. Bioquímica
- 12. TAMPÕES Um tampão é uma mistura de um ácido não- dissociado e sua base conjugada (a forma do ácido que perdeu seu próton). Isso leva a solução a resistir a alterações no pH quando H+ ou OH– é adicionado. Um tampão tem uma maior capacidade de tamponamento na escala próxima ao seu pKa (o logaritmo negativo do seu Ka). Dois fatores determinam a efetividade de um tampão, seu pKa relativo ao pH da solução e sua concentração. Bioquímica mecanismos respiratórios removem ácido carbônico através da expiração de CO2, e os rins excretam ácido com íon amônia (NH4+) e outros íons
- 14. ÁGUA Bioquímica
- 15. ÁGUA A água é o solvente da vida. Ela banha as células, dissolve e transporta compostos no sangue, fornece um meio para movimento de moléculas para o interior e, através dos compartimentos celulares, separa moléculas carregadas, dissipa calor e participa de reações químicas. A maioria dos compostos do corpo, incluindo proteínas, deve interagir com o meio aquoso. Apesar da variação na quantidade de água ingerida diariamente e produzida no metabolismo, o corpo mantém uma quantidade quase constante de água, que corresponde a cerca de 60% do peso corporal. Bioquímica
- 16. Compartimentos Líquidos no Corpo A água corporal total corresponde a aproximadamente 50 a 60% do peso corporal em adultos e 75% em crianças. Devido ao fato de a gordura ter relativamente pouca água associada a ela, pessoas obesas têm uma porcentagem mais baixa de água corporal do que pessoas magras, mulheres tendem a ter uma porcentagem mais baixa do que homens, e pessoas mais velhas têm uma porcentagem mais baixa do que pessoas mais jovens. Bioquímica
- 17. Compartimentos Líquidos no Corpo Cerca de 40% da água corporal total é intracelular, e 60%, extracelular. A água extracelular inclui o líquido no plasma (sangue após as células sanguíneas serem removidas) e a água intersticial (o líquido nos espaços teciduais, que fica entre as células). A água transcelular é uma porção pequena e especializada da água extracelular que inclui secreção gastrintestinal, urina, suor e líquidos que escapam através das paredes capilares devido ao excesso de pressão hidrostática ou inflamação. Bioquímica
- 18. Pontes de Hidrogênio na Água A natureza dipolar da molécula de água (H2O) permite que ela forme pontes de hidrogênio, uma propriedade que é responsável pelo papel da água como solvente. Na H2O, o átomo de oxigênio tem dois elétrons não-compartilhados que formam uma nuvem de elétrons densa em torno dele. Essa pode estar acima ou abaixo do plano formado pela molécula de água. Bioquímica
- 19. Pontes de Hidrogênio na Água Os átomos de hidrogênio e oxigênio da molécula de água formam pontes de hidrogênio e participam de camadas de hidratação. Uma ponte de hidrogênio é uma interação não- covalente fraca entre o hidrogênio de uma molécula e o átomo mais eletronegativo de uma molécula aceptora. O oxigênio da água pode formar pontes de hidrogênio com outras duas moléculas de água, dessa forma cada molécula de água é ligada por hidrogênio a aproximadamente quatro moléculas de água vizinhas em uma rede líquida tridimensional. Bioquímica
- 20. Bioquímica
- 21. Bioquímica
- 23. Água e regulação térmica A estrutura da água também permite que ela resista a mudanças de temperatura. Seu calor de fusão é alto, de tal modo que é necessária uma grande queda na temperatura para converter água líquida ao estado sólido (gelo). A condutividade térmica da água também é alta, facilitando, assim, a dissipação de calor de áreas de alto uso de energia, como o cérebro, para o sangue e para o pool de água corporal. Bioquímica
- 24. Água e regulação térmica Sua capacidade de calor e seu calor de vaporização são bastante elevados; quando água líquida é convertida em um gás e evapora da pele, o efeito de resfriamento é sentido. A água responde ao aumento de calor com a diminuição da quantidade de pontes de hidrogênio e ao resfriamento com o aumento da formação de pontes de hidrogênio entre as suas moléculas. Bioquímica
- 25. Eletrólitos Os líquidos extracelular (LEC) e intracelular (LIC) contêm eletrólitos, um termo geral aplicado a bicarbonato, ânions e cátions inorgânicos. Os eletrólitos são distribuídos entre os compartimentos de forma irregular. No LEC (plasma e líquido intersticial), os principais eletrólitos são Na+ e Cl– e, nas células, K+ e fosfatos como HPO4 –2. Essa distribuição é mantida principalmente pelos transportadores dependentes de energia que bombeiam Na+ para fora das células em troca de K+. Bioquímica
- 26. Bioquímica
- 27. Bioquímica
- 29. Bioquímica
- 30. Osmolalidade e Movimento de Água A água é distribuída entre os diferentes compartimentos líquidos de acordo com a concentração de solutos, ou osmolalidade, de cada um deles. A osmolalidade de um líquido é proporcional à concentração total de suas moléculas dissolvidas, incluindo íons, metabólitos orgânicos e proteínas (em geral é expressa como miliosmoles [mOsm]/kg de água). Bioquímica
- 31. Osmolalidade e Movimento de Água A membrana celular semipermeável que separa os compartimentos extra e intracelular contém um número de canais de íons através dos quais a água pode se mover livremente, mas outras moléculas não. Do mesmo modo, a água pode se mover livremente através de capilares que separam o líquido intersticial e o plasma. Como resultado, ela se move de um comparti- mento com concentração de solutos mais baixa (baixa osmolalidade) para um com concentração mais alta, para atingir uma osmolalidade igual em ambos os lados da membrana através da chamada pressão osmotica. Bioquímica
- 32. Osmolalidade e Movimento de Água Quando um compartimento líquido perde água, outro a repõe, para manter a osmolalidade constante. O sangue contém uma grande quantidade de proteínas carregadas negativamente, e são necessários eletrólitos para balancear essas cargas. À medida que a água passa do sangue para urina para balancear a excreção de íons, o volume sanguíneo é preenchido com água do líquido intersticial. Quando as osmolalidades do sangue e do líquido intersticial estão muito altas, a água se move para fora das células. Bioquímica
- 33. ÁCIDOS E BASES Ácidos são compostos que doam um íon hidrogênio (H+) para uma solução, e bases são compostos (como o íon OH-) que captam íons hidrogênio. Uma pequena parte da própria água se dissocia, gerando íons hidrogênio (H+) – os quais são também chamados de prótons – e íons hidróxido (OH-). A água é neutra, nem ácida nem básica. Bioquímica A dissociação da água.
- 34. O pH da Água A fração de dissociação das moléculas de água em H+ e OH– é muito leve, e a concentração de íons hidrogênio na água pura é apenas 0,0000001 M, ou 10–7 mol/L. A concentração de íons hidrogênio em uma solução é usualmente indicada pelo termo pH, o qual é o log10 negativo da concentração de íons hidrogênio expresso em mol/L. Portanto, o pH da água pura é 7. Bioquímica Definição de pH.
- 35. O pH da Água Um pH de 7 é considerado neutro, porque [H+] e [OH-] são iguais. Em relação à água pura, as soluções ácidas têm uma concentração maior de íons hidrogênio e uma concentração menor de íons hidróxido (pH<7,0). E as soluções básicas têm uma concentração menor de íons hidrogênio e uma concentração maior de íons hidróxido (pH>7,0). Bioquímica
- 36. Bioquímica Boca pH 6,7 Intestino delgado pH 8 Estômago pH 2
- 37. Ácidos Fortes e Fracos Durante o metabolismo, o corpo produz um número de ácidos que aumentam a concentração de íons hidrogênio no sangue ou em outros líquidos corporais e tendem a reduzir o pH. Bioquímica
- 38. Bioquímica
- 39. Ácidos Fortes e Fracos Esses ácidos, metabolicamente importantes, podem ser classificados como ácidos fracos ou ácidos fortes pelo seu grau de dissociação em um íon hidrogênio e uma base (o componente aniônico). Ácidos inorgânicos, como ácido sulfúrico (H2SO4) e ácido clorídrico (HCl), são ácidos fortes que se dissociam completamente em solução. Ácidos orgânicos que contêm grupos de ácidos carboxílicos (ex.: os corpos cetônicos ácido acetoacético e ácido β-hidróxi-butírico) são ácidos fracos que se dissolvem apenas de forma limitada em água. Em geral, um ácido fraco (HA), chamado de ácido conjugado, dissocia-se em um íon hidrogênio e um componente aniônico (A-), chamado de base conjugada. Bioquímica
- 40. Bioquímica Dissociação de ácidos. O ácido sulfúrico é um ácido forte que se dissocia em íons H+ e sulfato. Os corpos cetônicos, ácido acetoacético e ácido β-hidroxi-butírico são ácidos fracos que se dissociam de forma parcial em íons H+ e suas bases conjugadas. grande concentração de H+ dissociação total dissociação parcial
- 41. TAMPÕES Os tampões consistem em um ácido fraco e sua base conjugada e fazem com que uma solução resista a alterações no pH quando íons hidrogênio ou íons hidróxido são adicionados. Bioquímica
- 42. ÁCIDOS METABÓLICOS E TAMPÕES Bioquímica Uma taxa média de atividade metabólica produz cerca de 22.000 mEq de ácido por dia. Se todo esse ácido fosse dissolvido de uma vez nos líquidos corporais não-tamponados, o pH neles seria menor do que 1. Contudo, o pH do sangue é mantido normalmente entre 7,36 e 7,44, e o pH intracelular em cerca de 7,1 (entre 6,9 e 7,4). A maior variação do pH extracelular na qual as funções metabólicas do fígado, o batimento do coração e a condução do impulso neural podem ser mantidas é 6,8 a 7,8. Portanto, até que o ácido produzido pelo metabolismo possa ser excretado como CO2 no ar expirado e como íons na urina, ele precisa ser tamponado nos líquidos corporais.
- 43. ÁCIDOS METABÓLICOS E TAMPÕES Bioquímica Os maiores sistemas tamponantes do corpo são: o sistema-tampão bicarbonato-ácido carbônico, o qual opera principalmente no líquido extracelular; o sistema-tampão da hemoglobina nos eritrócitos; o sistema-tampão fosfato em todos os tipos de células; o sistema-tampão de proteínas das células e do plasma.
- 44. Bioquímica Água, Ácidos, Bases e Tampões Homeostase de líquidos corporais (balanço hídrico corporal constante). A ingesta é influenciada por disponibilidade de líquidos e alimentos, sede, fome e habilidade de engolir. A frequência, evaporação respiratórias e o volume urinário influenciam a perda de água. O corpo ajusta o volume de excreção urinária para compensar as variações nos outros tipos de perda de água e na ingesta. Os hormônios aldosterona e antidiurético (ADH) auxiliam o monitoramento do volume sanguíneo e da osmolalidade por meio de mecanismos regulatórios da sede e do equilíbrio de sódio e água.
- 45. Bioquímica Água, Ácidos, Bases e Tampões