O documento discute o equilíbrio de solubilidade de precipitação, incluindo:
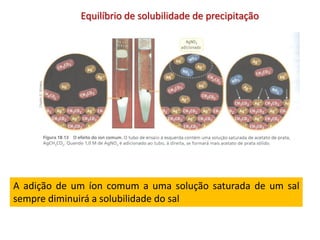
1) A definição de solução saturada e a equação geral para o equilíbrio químico de um sal que se dissolve;
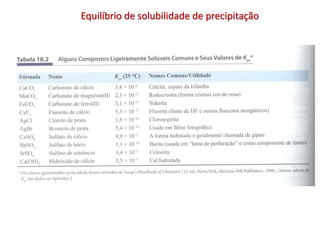
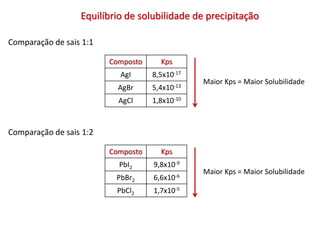
2) A definição de solubilidade e constante do produto de solubilidade Kps;
3) Exemplos de cálculos envolvendo Kps e a solubilidade de sais.

![Solução saturada: quando o máximo possível do sal está dissolvido.
AgBr (s) Ag+ (aq) + Br- (aq)
Kps = [Ag+] [Br-]
Fórmula geral:
AxBy (s) xAy+ (aq) + yBx- (aq)
Kps = [Ay+]x [Bx-]y
Equilíbrio de solubilidade de precipitação](https://image.slidesharecdn.com/aula7teorica-160210005018/85/Aula-7-teorica-2-320.jpg)