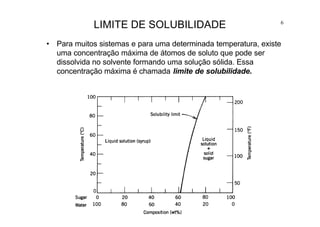
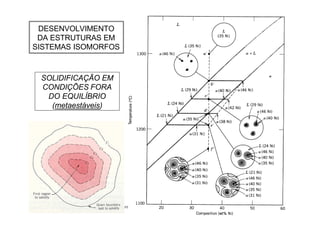
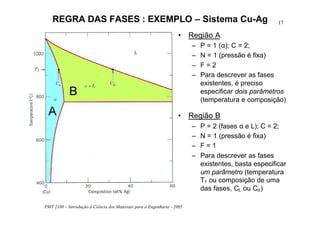
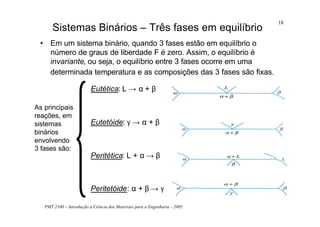
O documento apresenta os principais tópicos sobre diagramas de fases que serão abordados na aula, incluindo definições de componentes, sistemas, fases e equilíbrio, além de regra da alavanca, regra das fases e transformações em sistemas binários como eutética e eutetóide. O roteiro também descreve o desenvolvimento de estruturas em sistemas binários em condições de equilíbrio e fora do equilíbrio.












![PMT 2100 – Introdução à Ciência dos Materiais para a Engenharia - 2005
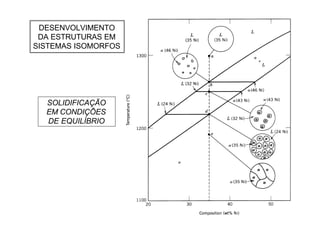
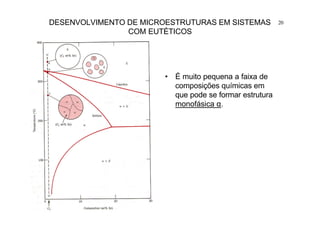
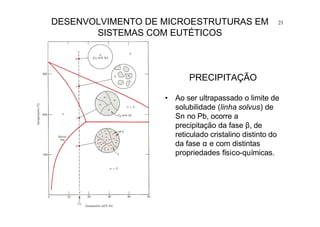
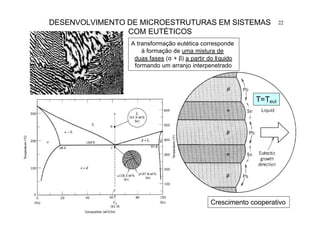
23DESENVOLVIMENTO DE MICROESTRUTURAS EM SISTEMAS
COM EUTÉTICOS
Em ligas hipo-eutéticas
ocorre inicialmente
precipitação de fase
primária - dendritas de α
pró-eutéticas.
O líquido eutético
residual L (61,9% Sn) se
transforma em
microestrutura eutética
[α(18,3% Sn)+β(97,8%Sn)].](https://image.slidesharecdn.com/aula0520051p-170418192341/85/Aula05-2005-1p-23-320.jpg)
