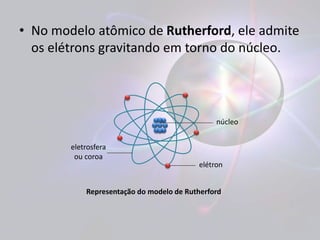
Este documento discute o modelo atômico de Rutherford, introduzindo o conceito de núcleo atômico. Rutherford observou que a maioria das partículas alfa atravessava folhas de ouro sem desvio, indicando que os átomos são principalmente vazios. Isso levou ao modelo de Rutherford com elétrons orbitando um núcleo denso de prótons e nêutrons, semelhante ao sistema solar. No entanto, este modelo apresentava falhas segundo a teoria eletromagnética, já que os elétrons em