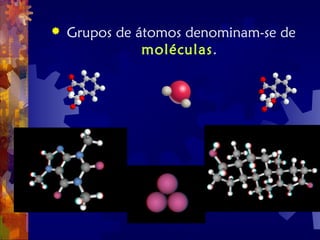
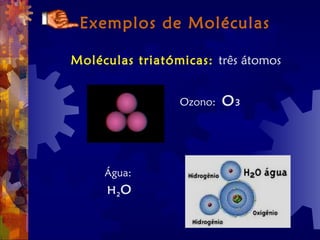
O documento descreve o que é matéria, desde as partículas subatômicas até os sistemas solares e galáxias. Explica que a matéria é composta de átomos que se unem em moléculas e macromoléculas, formando células, tecidos, órgãos e organismos. Descute também que átomos podem se tornar íons com carga elétrica ao ganhar ou perder elétrons.