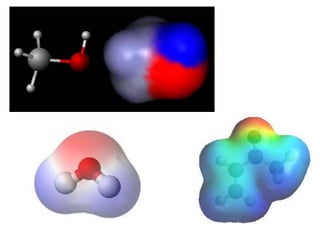
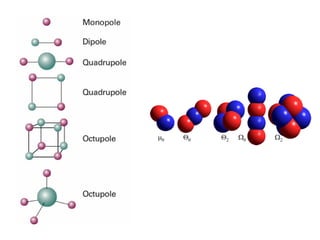
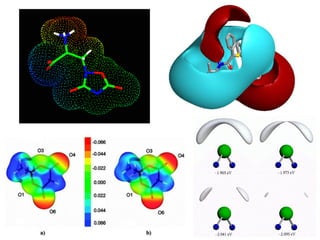
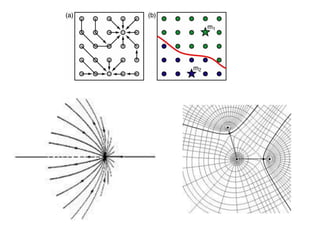
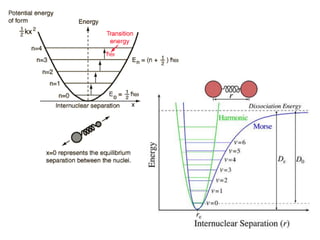
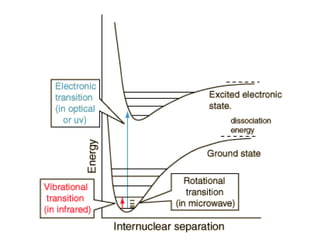
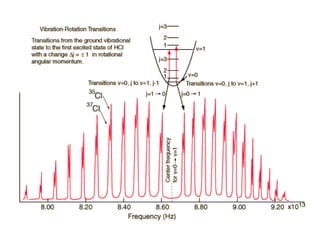
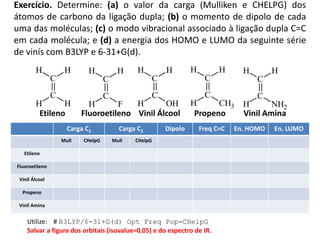
O documento aborda a distribuição de cargas em moléculas e suas propriedades espectroscópicas, discutindo conceitos como momento de multipólo, potencial eletrostático molecular, e cargas atômicas parciais. Inclui metodologias teóricas e experimentais para avaliar polarizabilidade, ionização e espectroscopia molecular. A análise também se estende à comparação de diferentes modelos de cálculo e suas aplicações na química computacional.