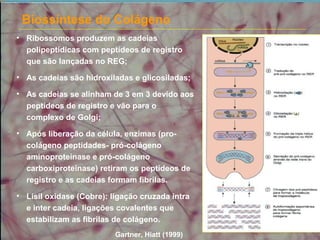
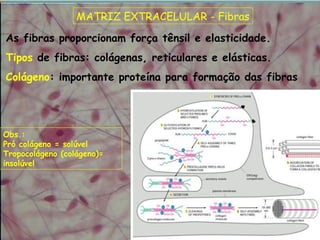
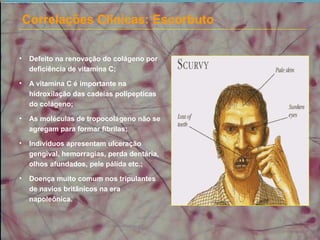
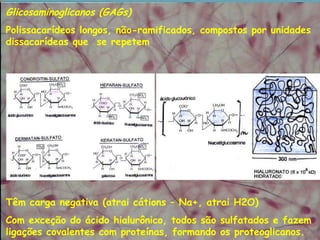
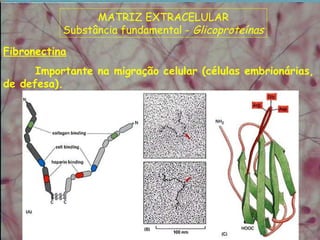
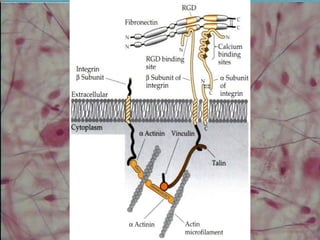
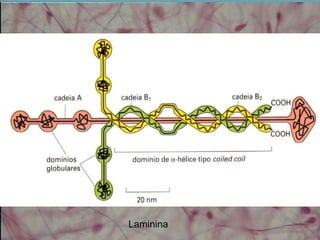
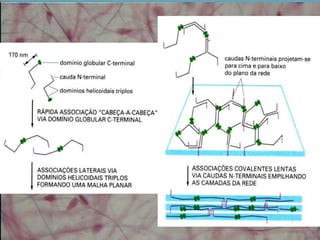
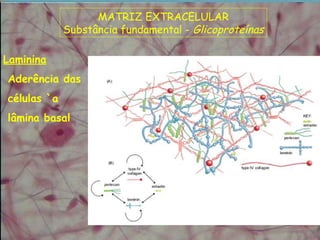
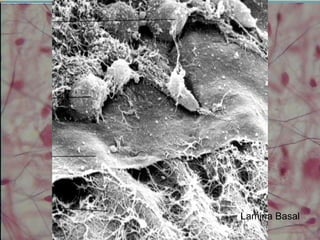
O documento descreve os principais componentes da matriz extracelular, incluindo suas funções e tipos. Resume os seguintes pontos essenciais:
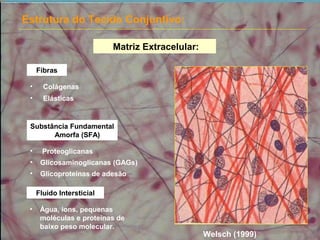
1) A matriz extracelular é composta por fibras (colágenas e elásticas), substância fundamental amorfa e glicoproteínas de adesão.
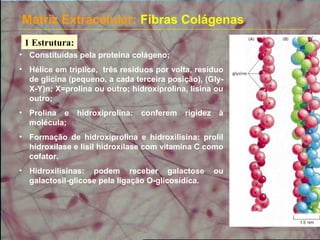
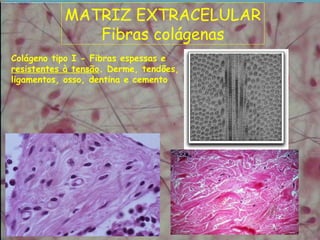
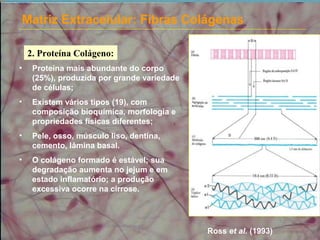
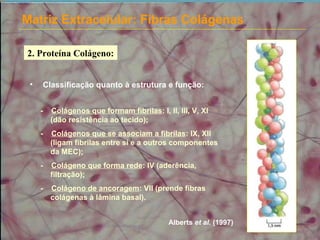
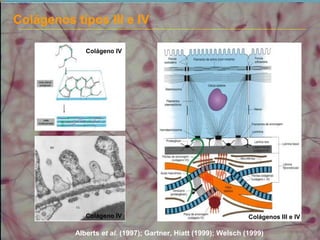
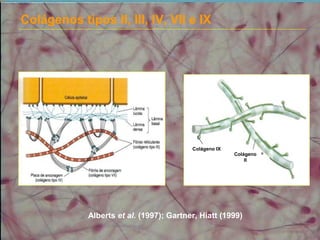
2) As fibras colágenas, principal proteína do corpo, formam hélices em triplice conferindo resistência aos tecidos. Existem diferentes tipos de colágeno.
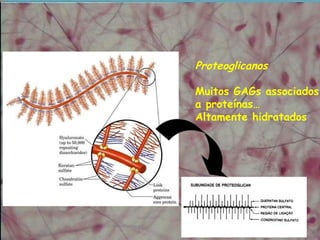
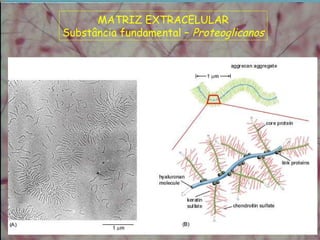
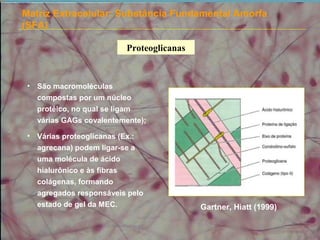
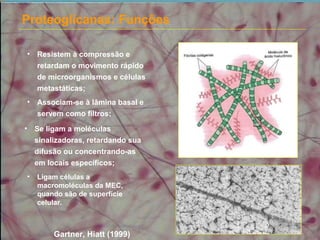
3) A substância fundamental amorfa inclui prote