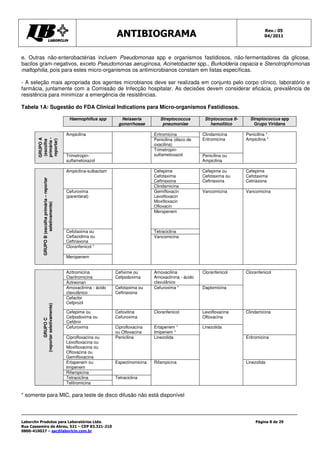
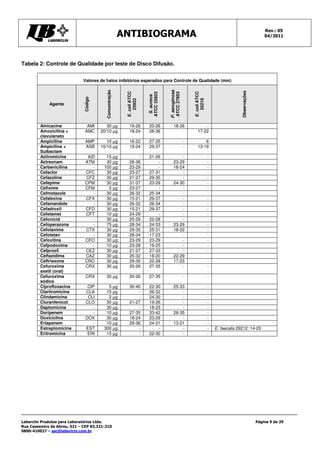
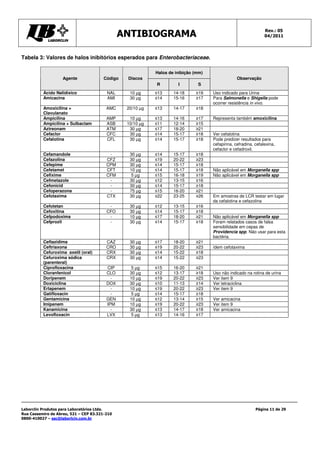
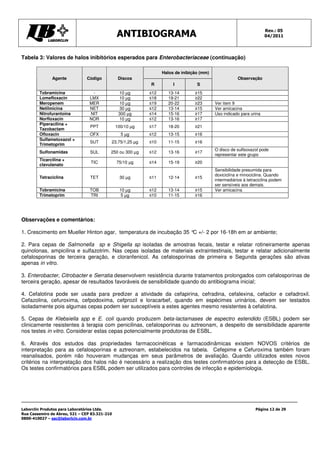
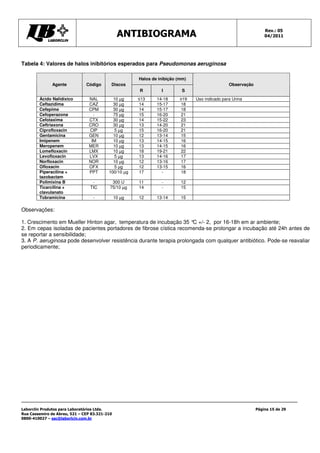
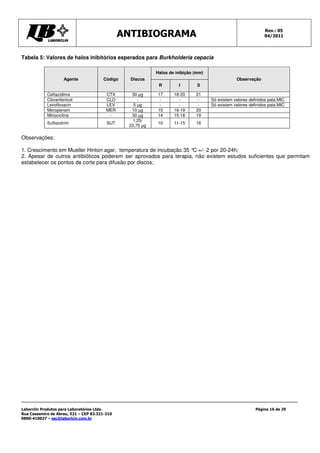
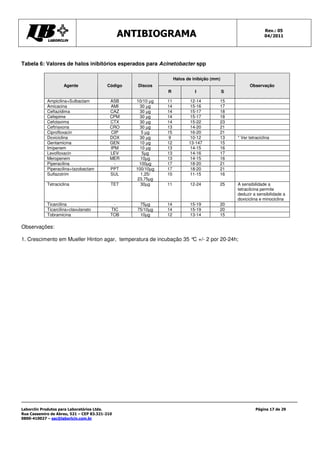
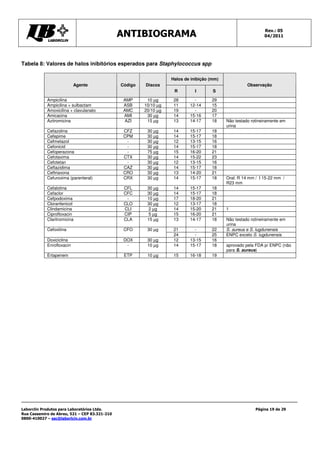
Este documento fornece instruções detalhadas sobre como realizar o teste de antibiograma usando a técnica de Kirby-Bauer, incluindo a preparação da amostra bacteriana, escolha dos discos de antibióticos, execução do teste e interpretação dos resultados. É importante seguir rigorosamente os procedimentos padronizados para garantir a precisão dos resultados.