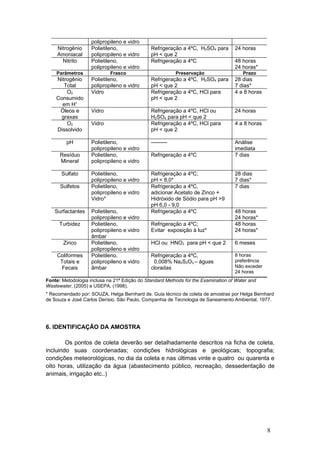
O documento aborda a importância da coleta e análise de amostras de água para garantir a qualidade do abastecimento e a saúde pública, apresentando diretrizes e normas para a correta realização do procedimento. O manual inclui informações sobre planejamento, prescrição de amostras e práticas de preservação, além de recomendações específicas para diferentes parâmetros de qualidade da água. Destaca a necessidade de técnicas rigorosas para evitar contaminações e assegurar resultados confiáveis nas análises.