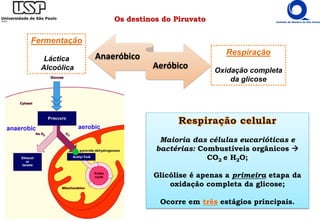
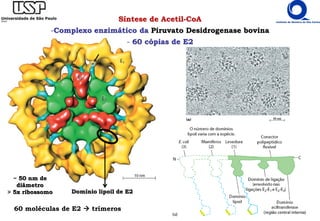
O documento descreve o ciclo do ácido cítrico, também conhecido como ciclo de Krebs ou ciclo do ácido tricarboxílico. O ciclo ocorre na mitocôndria e é a principal via de oxidação de carboidratos, aminoácidos e ácidos graxos, gerando energia na forma de NADH, FADH2 e GTP. O documento detalha as oito reações do ciclo e como ele é regulado pela disponibilidade de substratos e produtos.
























![Ciclo do ácido Cítrico
8) MALATO-DESIDROGENASE
- oxidação da OH do Malato regenera oxaloacetato
- dependente de NAD+ similar à lactato desidrogenase
- reação endergônica reação dirigida pela retirado do produto
- [oxaloacetato] é mínima retirado pela citrato sintase e outros ΔG < 0 exergônica](https://image.slidesharecdn.com/ciclodekrebs-221024195648-92ab1dd9/85/Ciclo-de-Krebs-pdf-27-320.jpg)








