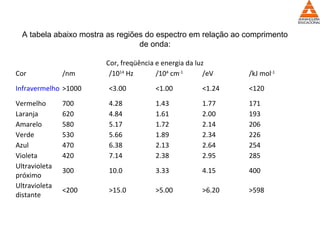
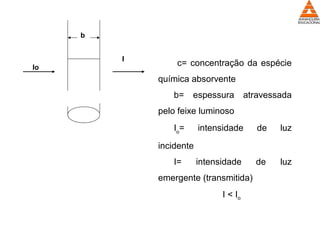
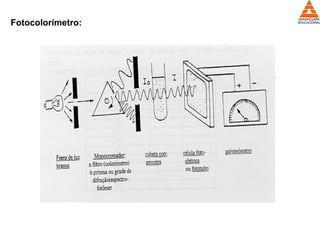
O documento descreve os equipamentos e técnicas utilizadas em laboratórios de bioquímica clínica, incluindo espectrofotômetros para realizar dosagens colorimétricas e enzimáticas que medem a absorção de luz por amostras. Também apresenta normas de biossegurança para esses laboratórios.