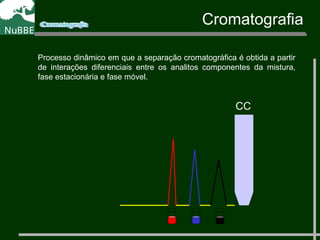
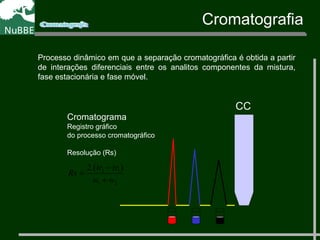
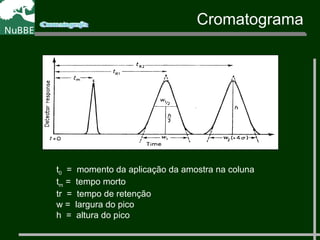
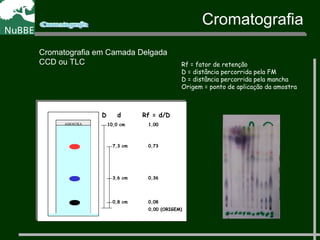
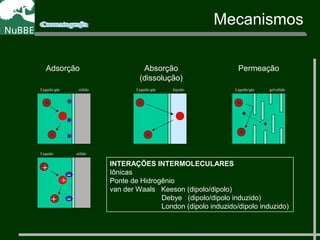
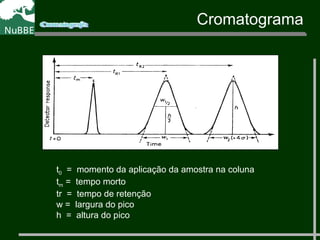
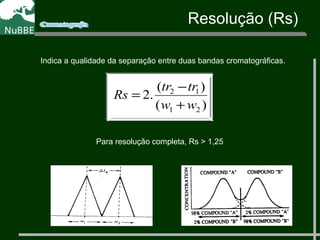
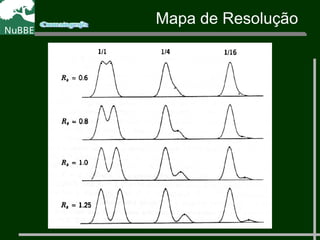
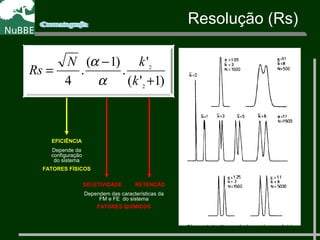
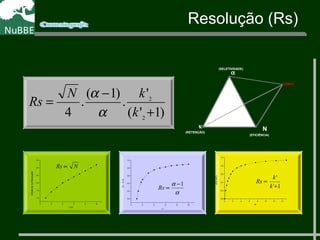
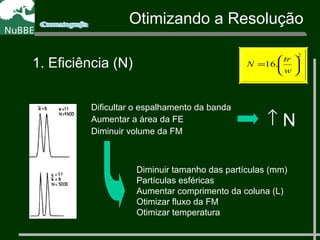
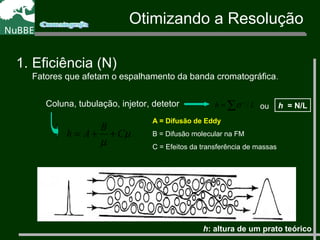
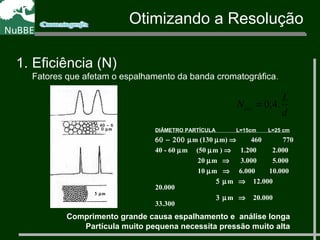
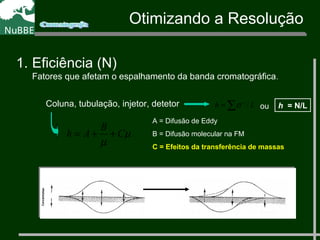
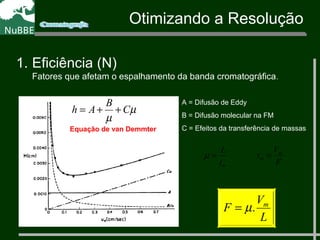
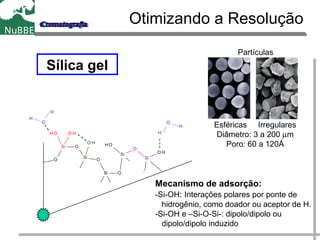
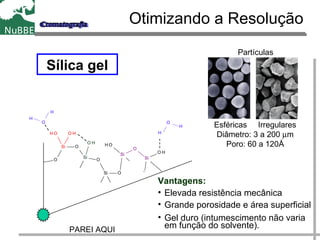
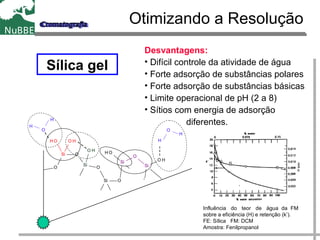
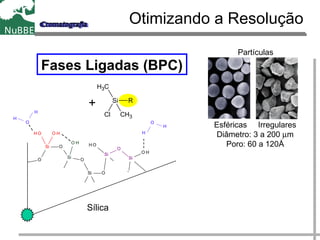
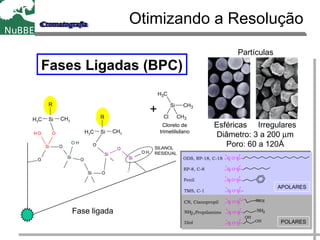
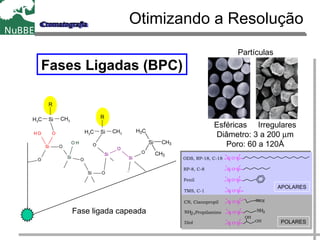
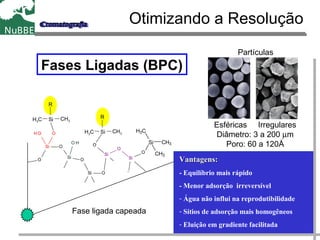
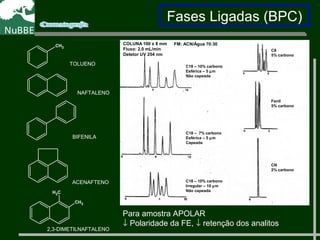
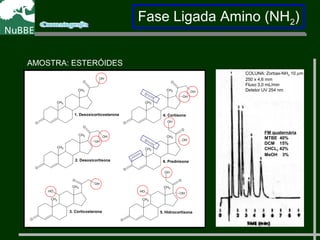
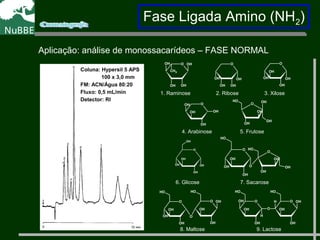
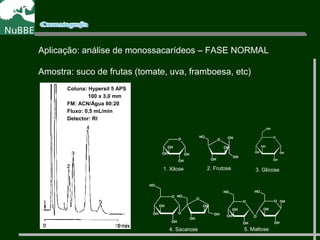
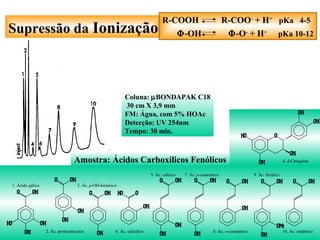
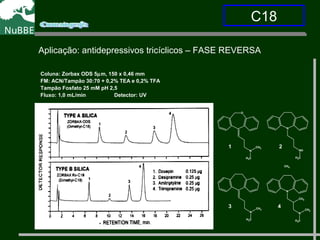
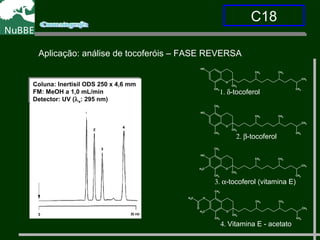
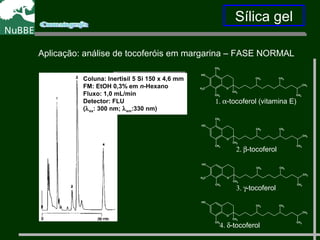
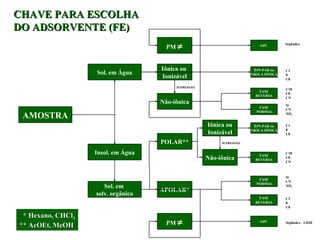
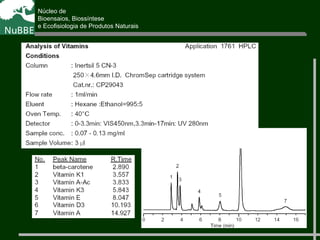
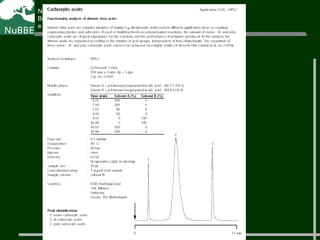
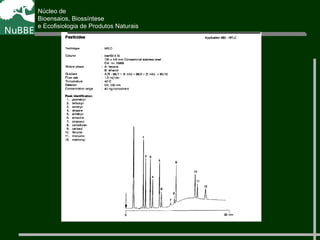
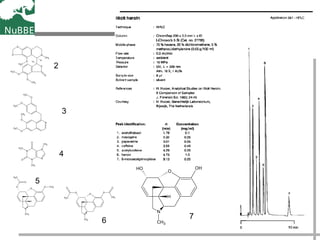
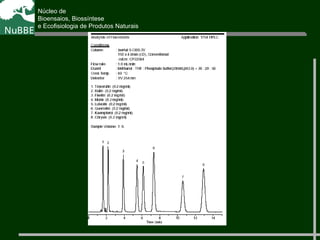
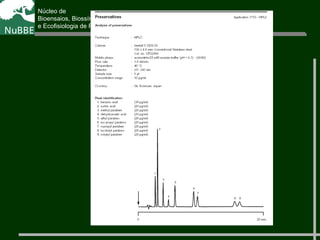
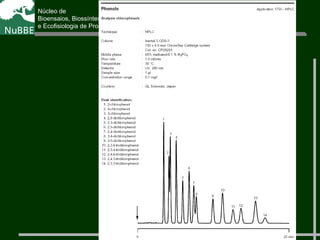
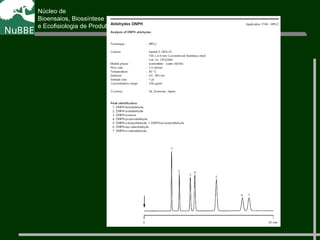
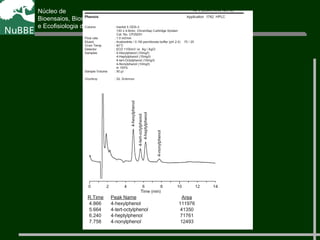
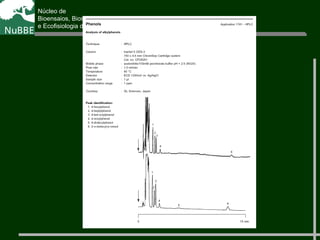
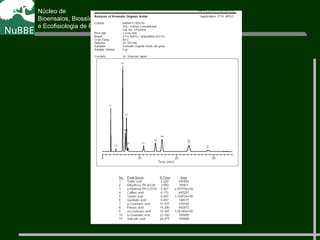
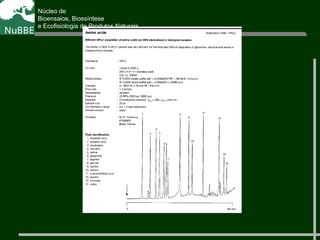
O documento apresenta um resumo sobre cromatografia líquida e suas técnicas. Descreve os principais conceitos como fases móvel e estacionária, fatores de retenção, resolução e eficiência. Também explica os mecanismos de separação e fatores que influenciam a qualidade da separação cromatográfica.




![Fase Extratora
a + B
A + b
A + B Mistura
HeterogêneaF1
F2
Mistura
Homogênea
(Amostra)
a + b
A + b
a + B
a + b
A + b
a + B
n etapas
[A]F2
[A]F1
KA=
[B]F2
[B]F1
KB=
Princípio Geral](https://image.slidesharecdn.com/aula01-introduo-150112091129-conversion-gate01/85/Aula-01-introducao-5-320.jpg)


![Fase Extratora
a + B
A + b
A + B Mistura
HeterogêneaF1
F2
Mistura
Homogênea
(Amostra)
a + b
A + b
a + B
a + b
A + b
a + B
n etapas
[A]F2
[A]F1
KA=
[B]F2
[B]F1
KB=
Princípio Geral](https://image.slidesharecdn.com/aula01-introduo-150112091129-conversion-gate01/85/Aula-01-introducao-8-320.jpg)