Aula 3-titulação-ácido-base
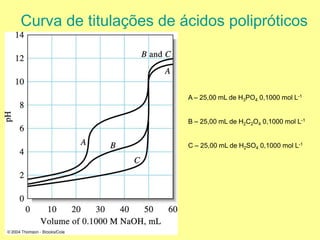
- 1. Curva de titulações de ácidos polipróticos A – 25,00 mL de H3PO4 0,1000 mol L-1 B – 25,00 mL de H2C2O4 0,1000 mol L-1 C – 25,00 mL de H2SO4 0,1000 mol L-1
- 2. Ácido poliprótico neutralizado por base forte •A forma da curva de titulação depende da magnitude relativa das várias constantes de dissociação (ou seja, pode exibir 2 ou mais pontos finais). •Se Ka1 / Ka2 > 103 o tratamento dos cálculos pode ser feito como para os ácidos monopróticos. •Supondo um ácido diprótico H2A com constante de dissociação Ka1 = 1,00 x 10-3 e Ka2 = 1,00 x 10-7.
- 3. Região A – pH inicial: pH pode ser dado pela contribuição do [H3O+] proveniente da primeira dissociação. Região B – 1a região tamponada: consiste de H2A e sua base conjugada NaHA. Região C – 1o P.E.: formação de um sal ácido. Região D – 2a região tamponada: consiste de HA- e sua base conjugada Na2A. Região E – 2o P.E.: consiste de uma base conjugada de ácido fraco com uma constante de dissociação Ka2. Região F - Após 2o P.E.: excesso de OH-.
- 4. Exemplo Construir uma curva de titulação de 25,00 mL de ácido maleico, HOOC-CH=CH-COOH, 0,1000 mol L-1 com NaOH 0,1000 mol L-1. Ka1 / Ka2 > 103 pH inicial H2M + H2O H3O+ + HM- Ka1 = 1,3 x 10-2 HM- + H2O H3O+ + M2- Ka2 = 5,9 x 10-7 52 , 1 10 01 , 3 ] [ 10 3 , 1 ] [ 1000 , 0 ] [ 1 2 3 2 3 2 3 1 pH L mol x O H x O H O H Ka
- 5. Relembrando....... HA + H2O ⇌ H3O+ + A- A- + H2O ⇌ OH- + HA Para encontrar o pH de uma solução contendo tanto um ácido, HA, quanto sua base conjugada, NaA, precisamos expressar as concentrações de HA e NaA, no equilíbrio, em termos de cHA e cNaA. Um exame dos dois equilíbrios revela que a primeira reação decresce a concentração de HA por uma quantidade igual a [H3O+], enquanto a segunda aumenta a concentração de HA por quantidade igual a [OH-]. ] [ ] [ ] [ ] [ ] [ ] [ 3 3 | OH O H c A OH O H c HA NaA HA
- 6. 1a região tamponada A adição de 5,00 mL de base resulta na formação de uma tampão do ácido fraco H2M e sua base conjugada HM-. Considerando a formação de M2- desprezível: 1 2 10 67 , 1 00 , 30 1000 , 0 00 , 5 ] [ L mol x x HM cNaHM 1 2 10 67 , 6 00 , 30 1000 , 0 00 , 5 1000 , 0 00 , 25 2 L mol x x x c M H ] [ ] [ ] [ ] [ ] [ ] [ 3 2 3 2 OH O H c M H OH O H c HM M H NaHM Desprezível 74 , 1 10 81 , 1 ] [ 10 3 , 1 ] [ ] ][ [ 1 2 3 2 2 3 1 pH L mol x O H x M H HM O H Ka
- 7. Logo antes do 1o P.E. A [H2M] é tão pequena que se torna comparável à [M2-] e o segundo equilíbrio precisa também ser considerado. Vadicionado = 24,90 mL 1 2 10 99 , 4 90 , 49 1000 , 0 90 , 24 ] [ L mol x x HM cNaHM 1 4 10 00 , 2 90 , 49 1000 , 0 90 , 24 1000 , 0 00 , 25 2 L mol x x x c M H ] [ ] [ 2 ] [ ] [ ] [ : ] [ ] [ ] [ : 2 3 2 2 2 OH M HM Na O H BC M HM M H c c BM NaHM M H cNaHM desprezível
- 8. ] [ ] [ ] [ ] [ ] [ ] [ ] [ ] [ 2 ] [ 2 2 3 2 2 3 2 2 2 M H M c O H c M HM M H c O H M HM c M H M H NaHM NaHM ] [ ] ][ [ ] [ ] ][ [ 2 3 2 2 3 1 HM M O H K M H HM O H K a a 99 , 3 10 014 , 1 ] ][ [ ] [ ] [ ] [ 1 4 1 3 3 2 3 2 pH L mol x K HM O H O H HM K c O H a a M H
- 9. No 1o P.E. 1 2 10 00 , 5 00 , 50 1000 , 0 00 , 25 ] [ L mol x x HM cNaHM HM NaHM NaHM c HM M H OH M O H OH M HM c O H BC M HM M H c BM ] [ ] [ ] [ ] [ ] [ ] [ ] [ 2 ] [ ] [ : ] [ ] [ ] [ : 2 2 3 2 3 2 2 11 , 4 10 80 , 7 ] ][ [ ] [ ] [ ] [ ] [ 1 5 1 3 3 3 2 3 pH L mol x K HM O H O H K O H HM K O H a w a pH = ½ (pKa1+pKa2)
- 10. Logo após o 1o P.E. Vadicionado = 25,01 mL Nessa região, a solução é constituída basicamente por HM- com algum M2- formado. ] [ ] [ 2 ] [ ] [ ] [ : 49999 , 0 ] [ ] [ ] [ : 10 996 , 1 ) ( 04997 , 0 ) ( 2 3 1 2 2 1 5 1 2 2 OH M HM Na O H BC L mol M HM M H c c BM L mol x V n n c L mol V n n n c NaHM M Na total NaHMform NaOHadic M total NaHMform NaOHadic NaHMform HM
- 11. ] [ ] [ ] [ ] [ ] [ ] [ ] [ ] [ ] [ 2 ] [ ] [ 2 2 3 2 2 2 3 OH Na M H M O H M M H OH M Na O H desprezível total NaHMform NaOHadic V n n ) ( ] [ ] [ 3 2 O H HM Ka 1 3 ] ][ [ a K HM O H 13 , 4 10 40 , 7 ] [ 1 5 3 pH L mol x O H
- 12. 2a região tamponada A adição de 25,50 mL de base resulta na formação de uma tampão do ácido fraco HM- e sua base conjugada M2-. total Mform Na NaOHadic Mform Na NaHM total Mform Na NaOHadic M Na V n n n c HM V n n c M ) ( ] [ ) ( ] [ 2 2 2 2 2 54 , 4 10 89 , 2 ] [ ] [ ] ][ [ 1 5 3 2 3 2 pH L mol x O H HM M O H Ka
- 13. Pouco antes do 2o P.E. Vadicionado = 49,90 mL Nessa região, a razão M2-/HM- torna-se grande e a equação para os tampões simples não se aplica mais. M2- + H2O HM- + OH- total Mform Na NaOHadic Mform Na NaHM total Mform Na NaOHadic M Na V n n n c HM V n n c M ) ( ] [ ) ( ] [ 2 2 2 2 2 61 , 8 ] [ ]) [ ]( [ ] [ ] ][ [ 2 2 2 1 pH OH c OH c OH M HM OH K K K M HM a w b
- 14. No 2o P.E. M2- + H2O HM- + OH- 38 , 9 ] [ ] [ ] [ ] [ ] [ ] ][ [ 2 2 2 2 1 pH OH c M HM OH M HM OH K K K M Na a w b total Mform Na NaOHadic M Na V n n c M ) ( ] [ 2 2 2
- 15. Logo após o 2o P.E. Vadicionado = 50,01 mL M2- + H2O HM- + OH- 14 , 10 ] [ ] [ ] [ ] [ ] [ ] [ ] [ ] [ 2 2 2 2 pH HM OH OH HM c M OH OH OH V produzido n c excesso M reagiu adicionado excesso total M M
- 16. Após o 2o P.E. Vadicionado = 51,00 mL Nessa região, o pH é dado pelo excesso de OH-. 12 , 11 ] [ ] [ ] [ pH OH OH OH reagiu adicionado excesso
- 17. Curva de titulação para 25,00 mL de ácido maleico
- 18. Base poliprótica neutralizada por ácido forte CO3 2- + H2O OH- + HCO3 - HCO3 - + H2O OH- + CO2 (aq) Kb1= Kw / Ka2 Kb2= Kw / Ka1
- 19. Espécies anfipróticas H2PO4 - + H2O H3O+ + HPO4 - H2PO4 - + H2O OH- + H3PO4 Ka2 = 6,3 2x 10-8 Kb3 = Kw / Ka1 = 1,41 x 10-12 Ka2 >> Kb3 titulação com solução padrão de base HPO4 2- + H2O H3O+ + PO4 3- HPO4 2- + H2O OH- + H2PO4 - Ka3 = 4,5 x 10-13 Kb2 = Kw / Ka2 = 1,58 x 10-7 Ka3 << Kb2 titulação com solução padrão de ácido
- 20. Misturas de ácidos fortes e fracos ou bases fortes e fracas Calcular o pH de uma mistura de HCl 0,1200 mol L-1 com ácido fraco HA 0,0800 mol L-1 (Ka = 1,00 x 10-4) durante sua titulação com KOH 0,100 mol L-1. Calcule os resultados para a adição dos seguintes volumes de base (a) 0,00 mL e (b) 5,00 mL. O H HCl O H A c O H 2 3 3 ] [ ] [ ] [ muito pequena desprezível Vadicionado = 0,00 mL [A-] <<< 0,1200 mol L-1 pH =0,92
- 21. Vadicionado = 5,00 mL Vmistura = 25,00 mL total reagiu inicial HCl V O nH O nH c 3 3 [A-] <<< cHCl pH =1,08 VKOH = 29,00 mL total HA HA total reagiu HCl HCl V O nH c V O nH O nH c 3 3 3 HA HCl c A HA A c O H ] [ ] [ ] [ ] [ 3 52 , 2 10 03 , 3 ] [ ] [ ] ][ [ 1 3 3 3 pH L mol x O H HA A O H Ka
- 22. Uma solução contém NaHCO3, Na2CO3 e NaOH, isoladamente ou em uma combinação permitida. A titulação de uma alíquota de 50,00 mL requer, empregando-se a fenolftaleína como indicador de ponto final, 22,1 mL de HCl 0,100 mol L-1. Uma segunda alíquota de 50,0 mL necessita de 48,4 mL de HCl quando titulada com indicador verde de bromocresol. Deduza a composição e calcule as concentrações molares dos solutos na solução original.
- 26. Exercício Uma amostra de Na2CO3 contaminada com NaOH foi pesada, dissolvida em água destilada isenta de CO2 e titulada com solução padrão de HCl 0,25 mol L-1. Usando-se fenolftaleína como indicador, observou-se o ponto final após adição de 26,20 mL do titulante. Após a viragem da fenolftaleína, adicionou-se algumas gotas de alaranjado de metila, prosseguindo-se a titulação com HCl. Foi necessária a adição de mais 15,20 mL do titulante para que se observa-se o ponto final com o alaranjado de metila. Calcule as massas de NaOH e Na2CO3 presentes na amostra.
- 27. Retrotitulação Uma amostra de 0,7121 g de farinha de trigo foi analisada pelo método Kjeldahl. A amônia formada pela adição de uma base concentrada após a digestão com H2SO4 foi destilada em 25,00 mL de HCl 0,04977 mol L-1. O excesso de HCl foi retrotitulado com 3,97 mL de NaOH 0,04012 mol L-1. Calcule a porcentagem de N na farinha. 1341 , 2 % 100 % 0850 , 1 1593 , 0 2443 , 1 x m xPA n N mmol n n n mmol n mmol n amostra N NaOH HCl N NaOH HCl
- 28. Exercício O teor de formaldeído da preparação de um pesticida foi determinado pela pesagem de 0,3124 g de uma amostra líquida em um frasco contendo 50,0 mL de NaOH 0,0996 mol L-1 e 50,00 mL de H2O2 3%. Por aquecimento, ocorreu a seguinte reação: Após esfriar, o excesso de base foi titulado com 23,3 mL de H2SO4 0,05250 mol L-1. Calcular a porcentagem de HCHO (30,026 g mol-1) na amostra. OH- + HCHO + H2O2 HCOO- + 2H2O
- 29. Atividade Elabore três questões objetivas com assuntos pertinentes as aulas 1, 2 ou 3.