Aula anne solsi química 1º ano (aula 1)
- 1. Evolução dos Modelos Atómicos
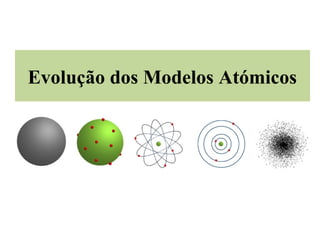
- 2. Modelo Atómico de Dalton John Dalton (químico inglês) propôs o primeiro Modelo Atómico, em 1807. O átomo era rígido, indivisível, indestrutível e tinha uma forma esférica. John Dalton (1766-1844)
- 3. Modelo Atómico de Thomson Em 1904, Thomson, propôs um novo modelo (Modelo Atómico de Thomson). Admitiu que o átomo era uma esfera maciça de carga positiva, estando os eletróns dispersos no seu interior. (tal como as passas Joseph Thomson (1856-1940) num pudim). Modelo do “ Pudim de passas”.
- 4. Modelo Atómico de Rutherford Rutherford (1871-1937) 1.A grande maioria dos raios α passou pela lâmina. 2. Foram poucos os raios α reflectidos pela lâmina. 3. Pouquíssimos raios α passaram pela lâmina sofrendo desvio.
- 5. A maior parte do espaço do átomo é espaço vazio. No seu interior, existe uma pequena região central positiva (núcleo). No núcleo encontra-se a maior parte da massa do átomo. Os eletróns giram à volta do núcleo em órbitas circulares. Também conhecido como o modelo Planetário.
- 6. Modelo Atómico de Bohr Concebido, em 1913, por Bohr. (físico dinamarquês) O átomo possuí um núcleo central. Niels Bohr Os eletróns descrevem órbitas circulares em (1885-1962) torno do núcleo. Os eletróns só podem ocupar determinados níveis de energia. A cada órbita corresponde um valor de energia.
- 7. Modelo Actual – Modelo da Nuvem Electrónica Os eletróns nos átomos movem-se em torno do núcleo com elevada rapidez. É impossível determinar, simultaneamente, com exatidão a posição e a velocidade de um elétrons. (Princípio da Incerteza de Heisenberg) Representação simbólica da nuvem eletrónica
- 8. Modelo Actual – Modelo da Nuvem Electrónica O átomo possui um núcleo central de reduzidas dimensões e uma nuvem eletrónica. No núcleo encontram-se os protóns e os neutróns. Os eletróns encontram-se à volta do núcleo, na nuvem eletrónica. É possível falar em zonas onde a probabilidade de encontrar o eletróns é ORBITAIS maior.
