Este documento descreve conceitos fundamentais da atomística, incluindo:
1) Ondas eletromagnéticas e suas propriedades;
2) Descobertas experimentais que levaram ao desenvolvimento da teoria atômica, como raios catódicos e raios-X;
3) Teorias sobre a estrutura atômica, incluindo os modelos de Rutherford, Bohr e mecânica quântica;
4) Ligações químicas e classificação periódica dos elementos.


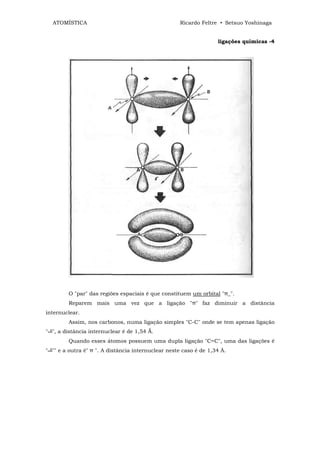
![ATOMÍSTICA Ricardo Feltre • Setsuo Yoshinaga
FICHA CATALOGRÁFICA
[Preparada pelo Centro de Catalogação-na-fonte,
Câmara Brasileira do Livro, SP]
Feltre, Ricardo, 1928-
F Atomística: teoria e exercícios |por| Ricardo Feltre
374a
|e| Setsuo Yoshinaga. São Paulo, Ed. Moderna,
1974.
477p. ilust.
1. Átomos 2. Moléculas I. Yoshinaga, Setsuo,
1937- II. Título.
CDD-539
-541.22
7 -541.24
74-0086
Índices para o catálogo sistemático:
1. Estrutura atômica: Química teórica 541.24
2. Estrutura molecular: Química 541.22
3. Física moderna: Ciências puras 539
4. Química molecular 541.22
É proibida a reprodução
total ou parcial deste livro, sob as
penas da lei.](https://image.slidesharecdn.com/atomstica-120323153146-phpapp02/85/Atomistica-3-320.jpg)






















































































































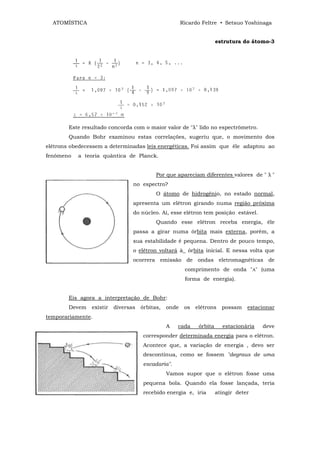

















































































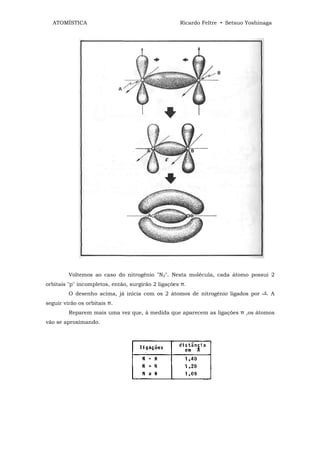
![ATOMÍSTICA Ricardo Feltre • Setsuo Yoshinaga
Eis a regra para a estruturação de 5xidos moleculares:
1) Escrever o elemento "E" com (8 – no. de grupo) traços.
2) Cada 2 traços de "E" recebe um átomo de oxigênio.
3) Os restantes oxigênios serão ligados com ligações coordenadas na forma
[ ->- 0 ] .
4) NO caso de moléculas do tipo E20X, admite-se uma simetria estrutural.
EXERCÍCIOS
1º. exemplo:
(217) Seja o SO2 - anidrido sulfuroso.
(8 – no. do grupo) = (8 - VI) = 2 traços.
S-
Coloca-se um átomo de oxigênio que utiliza 2 traços.
S=0
Tem ainda mais um átomo de oxigênio. Este se liga por coordenada.
S=0
↓
0
2º. exemplo:
(218) Seja o CO2 - anidrido carbônico.
no. de traços . . . ( - IV) = 4
Cada 2 traços recebe um átomo de oxigênio;
então, cabem os 2 átomos de oxigênio .
Não houve necessidade de ligação
coordenada.](https://image.slidesharecdn.com/atomstica-120323153146-phpapp02/85/Atomistica-211-320.jpg)






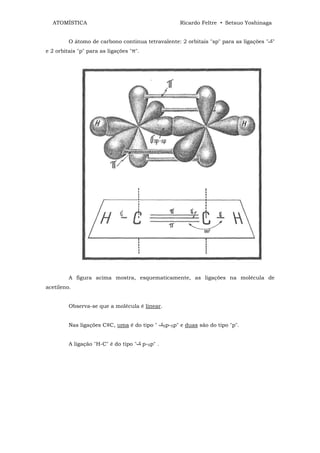
![ATOMÍSTICA Ricardo Feltre • Setsuo Yoshinaga
ligações químicas-4
(247) Na3PO4 - fosfato de sódio
(248) NH4NO3 - nitrato de amôneo
════════════════
CASOS ESPECIAIS DE FÓRMULAS ESTRUTURAIS
1º. caso: Ácidos com hidrogênios não ionizáveis
Na química inorgânica, destacam-se 2 ácidos de fósforo que apresentam "H"
não ionizáveis. Neste caso, o "H" não ionizável fica diretamente ligado ao "P".
H3PO3 - ácido fosforoso - tem 1 "H" não ionizável.
Sua fórmula estrutural é:
H3PO2 _ ácido hipofosforoso - tem 2 "H" não ionizáveis.
Sua formula estrutural é:
2º. caso: Peroxi-ácidos
Nos peroxi-compostos sempre está presente a forma [- 0 - 0 -].
EXERCÍCIOS
ExempIo:
(249) H2SO5 - ácido peroxissulfúrico](https://image.slidesharecdn.com/atomstica-120323153146-phpapp02/85/Atomistica-218-320.jpg)























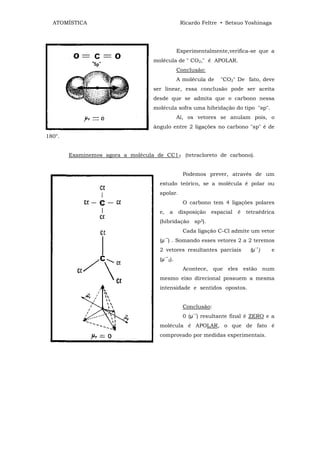



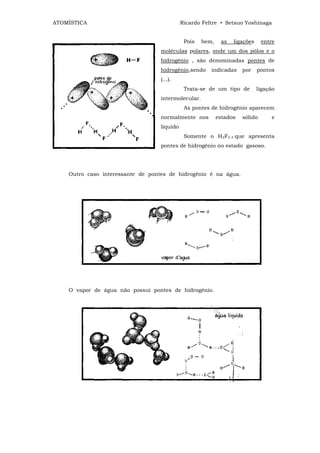










![ATOMÍSTICA Ricardo Feltre • Setsuo Yoshinaga
ligações químicas -4
Isto quer dizer que a atração entre Na+ e CI‾ diminui de 80 vezes, razão pela
qual esses íons se separam, ocasionando a solubilidade do sal na água.
Isto não aconteceria se a molécula do solvente fosse APOLAR, pois de modo
geral, os líquidos apolares (principalmente orgânicos) apresentam (Є ≈ 2). A força de
atração iônica é ainda suficientemente grande e mantém os íons unidos. O (Na+Cl‾) é
insolúvel na gasolina porque esse liquido é um solvente apolar.
Em outras palavras:
"Substancias iônicas são solúveis apenas em solventes polares".
Por outro lado, a naftalina (molécula apoiar) é insolúvel na água e solúvel
em solvente apolar como na gasolina.
A sacarose (açúcar) é solúvel na água, pois as moléculas de sacarose
possuem hidrogênio polarizado (-OH).
Em relação ã solubilidade vale a lei do Similis-similis: o semelhante dissolve
o semelhante.
Substâncias iônicas e polares são solúveis em solventes POLARES e
substancias apolares são solúveis em solventes apolares.
Quando a molécula é relativamente grande e possui parte polar e parte
apolar, será uma molécula parcialmente solúvel tanto na substância polar como na
apolar.
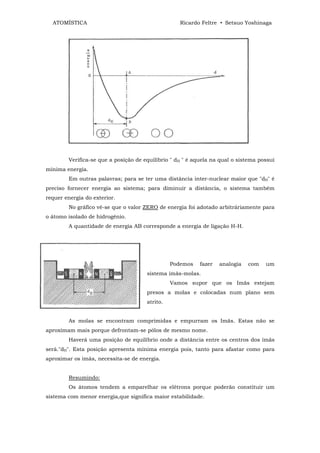
Substâncias desse tipo são, por exemplo, os detergentes. Os detergentes mais
antigos são os próprios sabões comuns. Eles possuem moléculas com 16, 17 ou 18
carbonos e radical polar. Uma de suas moléculas é:
Representaremos
assim: ☼ “ parte polar “
Geralmente, um tecido fica
impregnado com moléculas orgânicas
apolares, que são insolúveis na água. As
moléculas do sabão, através da parte apolar,
conseguem dissolver essas impregnações. Por
fim, esta solução, sabão-impregnação,pode
ser emulsionada na água já que as moléculas
do sabão possuem o radical -COO]‾ que é
polar. Sendo capaz de solvatar-se com
moléculas de água.
O que se acaba de concluir é que a
operação "lavar roupa com sabão" não é um fenômeno químico, mas sim, apenas uma
estratégica dissolução das impregnações, ou seja, um fenômeno físico.](https://image.slidesharecdn.com/atomstica-120323153146-phpapp02/85/Atomistica-262-320.jpg)







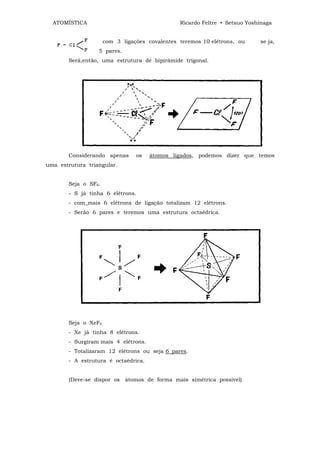









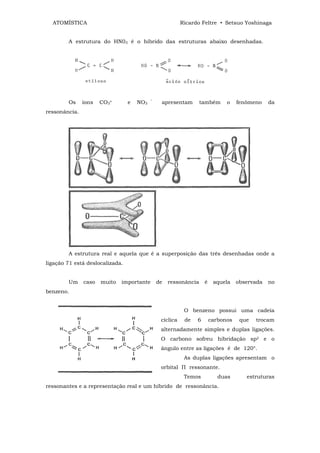
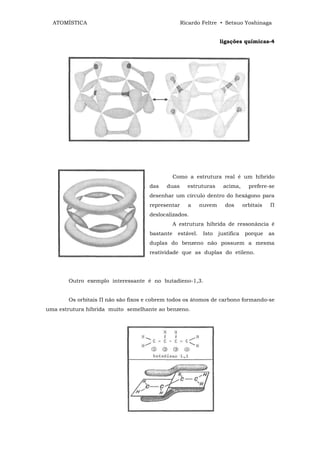















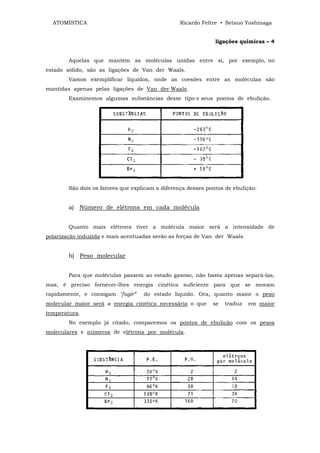
![ATOMÍSTICA Ricardo Feltre • Setsuo Yoshinaga
ligações químicas - 4
O dispositivo que acabamos de descrever é um retificador de corrente
alternada em corrente contínua. Tal dispositivo só deixa passar corrente elétrica num
único sentido, ou seja, do semi-condutor "p" para o "n".
_______________________
TRANSISTORES
_______________________
São dispositivos que vieram substituir válvulas eletrônicas. Uma das funções
da válvula eletrônica é a de amplificar impulsos (sinais) de um circuito. Por exemplo,
as ondas eletromagnéticas que se propagam no espaço produzem impulsos elétricos
numa antena que faz parte do circuito de rádio.
Dentro do aparelho, estes impulsos são amplificados até que possam fazer
vibrar uma membrana do altofalante e transformar-se em ondas sonoras.
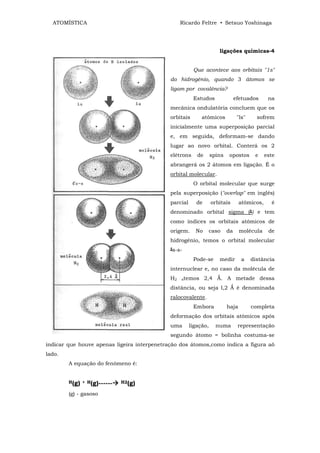
Um dispositivo que tem a mesma
função da válvula é o transistor. Vamos
descrever aquele que é constituído pela
junção de semi-condutores dopados n-p-n
que são respectivamente chamados de
emissor (E) , base (B) e coletor (C) .
Lembremos que:
a] POLARIZAÇÃO DIRETA - deixa passar corrente elétrica e a ligação e
"n" ao polo (─) (negativo) e "p" ao polo (+) (positivo).
b) POLARIZAÇÃO INVERSA - não passa corrente e a ligação é "n" ao polo (+)
e "p" ao polo (─)
A base B sempre atua como um polo (+) em relação a E que é (─).
A junção EB comporta-se como condutor porque apresenta uma polarização
direta.
A base B sempre atua como um polo (─) em relação a C que é (+) .
Então, a junção BC é um isolante, pois trata-se de uma polarização inversa.
Quando o circuito está ligado, elétrons atravessam do emissor E para a
base B.
Se a base B é um material de pequeníssima espessura (milésimo de polegada)
não dá tempo de B criar suficiente número de buracos para unir-se com os elétrons
vindos de E.
Então, esses elétrons, na maioria, atravessam a base caindo no coletor.](https://image.slidesharecdn.com/atomstica-120323153146-phpapp02/85/Atomistica-298-320.jpg)




















![ATOMÍSTICA Ricardo Feltre • Setsuo Yoshinaga
(378) Qual das seguintes afirmações, referentes à substância pura
CaCl2, é FALSA?
a) é pouco solúvel em benzeno
b) é um sólido cristalino
c) no estado sólido é mau condutor da eletricidade
d) em solução aquosa contem igual número de íons de cálcio e
íons de cloro
e) conduz a eletricidade em solução aquosa devido ao movimento dos
íons positivos de cálcio e íons negativos de cloro
(ITA-66)
(379) A estrutura do anidrido sulfuroso é:
(cada traço equivale a um par de elétrons e a seta a uma ligação
dativa)
(ITA-66)
(380) Na grade cristalina de ferricianeto de potássio
K3[ Fe(CN)6] existem:
a) cátions K+, cátions Fe + + + e ânions CN‾
b) cátions K+, cátions Fe++ e ânions CN‾
c) cátions K+ e ânions [Fe(CN)6]‾ ‾ ‾
d) cátions K+ , cátions Fe + + + e moléculas (CN)2
e) moléculas K3[Fe(CN)6]
(ITA-66)
(381) Qual das seguintes fórmulas eletrônicas é incorreta?
a) cloridreto, HC1
b) amoníaco, NH3
c) trifluoreto de boro, BF3
d) água, H20
e) ácido hipocloroso, HC10 (ITA-67)
(382) Usualmente os compostos iônicos se apresentam em condições
ambientes:
a) no estado liquido
b) no estado gasoso d) nos três estados de agregação
c) no estado sólido (EEU Mackenzie-64)](https://image.slidesharecdn.com/atomstica-120323153146-phpapp02/85/Atomistica-319-320.jpg)













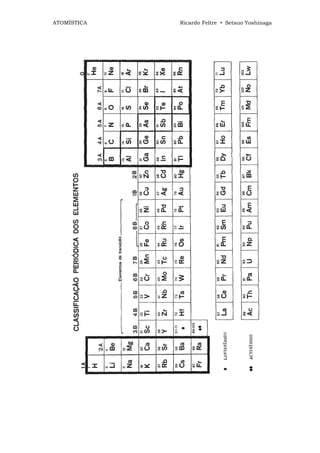












![ATOMÍSTICA Ricardo Feltre • Setsuo Yoshinaga
E POTENCIAL
DE IONIZAÇÃO
__________________________________________________________
1) DEFINIÇÃO DE ELÉTRON-VOLT (eV)
__________________________________________________________
Sejam 2 pontos de espaço
onde a diferença de potencial é de 1
volt. Vamos supor que um elétron
encontra-se no ponto de potencial
menor. Para transportá-lo ao ponto de
maior potencial é necessário fornecer
ao elétron a energia de 1 elétron volt
(1 eV) .
____________________________________________________________________________
Elétron-volt (eV) é a energia necessária para levar o elétron de um
ponto a outro onde a diferença de potencial é 1 volt.
____________________________________________________________________________
Relacionemos eV e joule.
Sabemos que 1 joule = 1 coulomb x 1 volt
Dimensionalmente: [energia] = [carga] x [tensão]](https://image.slidesharecdn.com/atomstica-120323153146-phpapp02/85/Atomistica-349-320.jpg)






![ATOMÍSTICA Ricardo Feltre • Setsuo Yoshinaga
classificação periódica dos elementos -5
A energia total (∆E) utilizada na dissociação da molécula A-B será:
1º. modo: ∆E = Pi(B) + [-Af(A)]
2º. modo: ∆E = Pi(A) + [-Af(B)]
No entanto, essas energias devem ser iguais desde que eles possuam a
mesma eletronegatividade.
Então:
Pi (B) - Af(A) = Pi-(A) - Af(B)
[Pi(B) + Af(B)]=[Pi(A) + Af(A)]
Por definição chamamos de:
X B e XA serão eletronegatividades de B e A.
O quociente 5,6 foi utilizado por Millikan para que os valores de X
coincidissem com os valores de eletronegatividade na escala de Pauling (a ser dada
depois).](https://image.slidesharecdn.com/atomstica-120323153146-phpapp02/85/Atomistica-356-320.jpg)
























![ATOMÍSTICA Ricardo Feltre • Setsuo Yoshinaga
A CONCEITOS DE
OXIDAÇÃO E REDUÇÃO
A palavra oxidação nasceu do fenômeno químico "combinar-se com o oxigênio".
Até hoje costuma-se dizer: "este parafuso oxidou-se" o que significa que o metal
combinou-se com o oxigênio.
Seja o átomo de cálcio combinando-se com o átomo de oxigênio.
Ca + [O] --- Cao
Como houve uma combinação com o oxigênio, diria-se: o cálcio oxidou-se.
Com a descoberta da estrutura eletrônica, verificou-se que, quando um
elemento combina-se com o oxigênio, aquele acaba perdendo elétrons para o oxigênio.
De fato, na reação mencionada temos:](https://image.slidesharecdn.com/atomstica-120323153146-phpapp02/85/Atomistica-381-320.jpg)
![ATOMÍSTICA Ricardo Feltre • Setsuo Yoshinaga
Como o leitor pode perceber, o cálcio perdeu 2 elétrons para o oxigênio.
Dizemos que o cálcio oxidou-se e o oxigênio reduziu-se.
Generalizando pode-se dizer:
OXIDAR-SE é perder elétrons
REDUZIR-SE e ganhar elétrons
Vamos agora equacionar o fenômeno e reparem as cargas que os átomos irão
adquirir:
Ca0 + [O] 0 ------ Ca++O=
Numa observação isolada para cada átomo temos:
Reparem que, quando um átomo perde elétron,ele fica mais positivo.
Chamemos, provisoriamente, a carga do átomo de NÚMERO DE OXIDAÇÃO (Nox.).
Então, quando um átomo oxida-se ocorre aumento no seu número de oxidação.
Analogamente para o oxigênio:
Ocorrendo uma redução verifica-se diminuição do número de oxidação:
Podemos dizer então que:
OXIDAR-SE é p er der e l é t r o n s ou aum ent ar o número de
oxidação
REDUZIR-SE é g a n h a r e l é t r o n s ou d i m i n u i r o número de
oxidação](https://image.slidesharecdn.com/atomstica-120323153146-phpapp02/85/Atomistica-382-320.jpg)
































![ATOMÍSTICA Ricardo Feltre • Setsuo Yoshinaga
óxido-redução – 6
(583) AsO4= + Zn + H+ Zn++ + H20 + AsH3
(584) Bi+++ + SnO2 + OH‾ SnO3= + H20 + Bi
(585) Co + + + BrO- + H+ Co+++ + Br2 + H2O
(586) [Fe(CN)6]≡ + H2O2 + OH- [Fe(CN)6]== + H2O + O2
═══════════════════
E MONTAGEM
DE EQUAÇÕES
D E Ó X ID O – R E D U Ç Ã O
Para escrever diretamente uma equação de oxi-redução seria muito
complicado e praticamente teríamos que "decorar" todas as reações.
Foi idealizado um processo totalmente teórico admitindo-se que numa oxi-
redução existem as seguintes "partes" da reação:
a) Decomposição do oxidante
b) Reação do redutor
c) Reações complementares
Por exemplo, seja a reação:
KMnO4, + HC1
Embora na prática não se observem as "partes" da reação, pode-se imaginar
que ocorreram as seguintes etapas:
a) Decomposição do oxidante:
2 KMnO4 K2O + 2 MnO + 5 [O]
b) Reação do redutor com [O]
2 HC1 + [O] H 2O + Cl2](https://image.slidesharecdn.com/atomstica-120323153146-phpapp02/85/Atomistica-415-320.jpg)
![ATOMÍSTICA Ricardo Feltre • Setsuo Yoshinaga
que multiplicado por 5 para "aproveitar" os 5 [O] vindos da primeira reação:
10 HC1 + 5 [O] 5 H2O + 5 Cl2
c) Reações complementares
São as reações que acompanham a oxi-reduçao. No caso, os óxidos K2O e
MnO reagem com HC1.
2 HC1 + K2O 2 KC1 + H2O
2 HC1 + MnO MnCl2 + H2O
É preciso ainda acertar os coeficientes.
Podemos montar as equações para depois somá-las e determinar a equação
real.
Vamos seguir a regra:
▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬
a) Escrever a decomposição do oxidante.
b) Escrever a equação do redutor + [O].
c) Assinalar todos os óxidos metálicos que reagirão com ácidos e produzirão
sal + água.
▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬▬
No caso anterior:
Para ajustar os coeficientes procure:
1) Ajustar primeiro cada equação parcial.
2) Só depois é que devemos ajustar a substância que surgiu numa equação e
que será consumida na outra.
Por exemplo: a última equação foi assim começada:
2 HC1 + MnO MnCl2 + H2O
Como existem 2 MnO na 1a. equação, então, foi multiplicada to da equação
por 2.](https://image.slidesharecdn.com/atomstica-120323153146-phpapp02/85/Atomistica-416-320.jpg)

![ATOMÍSTICA Ricardo Feltre • Setsuo Yoshinaga
8) 2 KMnO4 meio ácido K2O + 2 MnO + 5 [O]
9) 2 KMnO4 meio básico K2O + 2MnO2 + 3 [O]
10) K2Cr2O7 ácido K2O + Cr2O3 + 3 [O]
11) 2 Na3BiO4 3 Na2O + Bi2O3 + 2 [O]
12) KC103 KC1 + 3 [O]
13) NaClO NaCl + [O]
14) NaN03 NaNO2 + [O]
Observe que a maioria dos oxidantes produzem óxidos ± [O].
O HN03 possui decomposições diferentes conforme a concentração e
temperatura.
O KMnO4, possui decomposições diferentes conforme o meio seja ácido ou
básico.
Sugerimos "decorar" apenas as equações: 4, 5, 7, 8, 9 e 10. Essas
decompõem-se em óxido + óxido + [O] .
Os principais redutores e suas reações com [O] são:
1) H2S + [O] H2O + S
2) H2O2 + [O] H2O + O2
3) 2 HX + [O] H2O + X2 (X = Cl, Br e I)
4) 2 NaX + [O] Na2O + X2
5) H2S + 4 [O] H2SO4
6) SO2 + [O] SO3
7) PbCl2 + [O] + 2 HC1 PbC14 + H2O
8) 2 FeSO4 + [O] + H2SO4 Fe2(SO4)3 + H2O
9) H2C2O4 (oxálico) + [O] 2 CO2 + H2O
10) Me (metal) + [O] Me2O (Me monovalente)
11) Na2C2O4 + [O] Na2O + 2 CO2](https://image.slidesharecdn.com/atomstica-120323153146-phpapp02/85/Atomistica-418-320.jpg)

















![ATOMÍSTICA Ricardo Feltre • Setsuo Yoshinaga
conceitos modernos de ácidos e bases – 7
2) H2O + NH3 NH4+ + OH‾
3)
4) Mg + + + 6H2O [Mg.(OH2)6]+ +
(637) São reações de ácido-base de Bronsted
a) 1 e 2 d) somente 1
b) 1, 2 e 3 e) nenhuma das respostas anteriores
c) 3 e 4
(638) São reações de ácido-base de Lewis
a) 3 e 4 d) 1 e 2
b) 1, 2, 3 e 4 e) nenhuma das reações
c) somente 3
══════════════════
C FORÇAS DE
ÁCIDOS E BASES
____________________
DEFINIÇÕES
E COMPARAÇÕES
_____________________________
Um ácido pode ter maior ou menor facilidade em ceder prótons. Quanto mais
facilmente libertar prótons, dizemos que o ácido é mais forte.
Sejam os ácidos HC1 e HBr
HC1 ↔ H+ + Cl‾
HBr ↔ H+ + Br‾](https://image.slidesharecdn.com/atomstica-120323153146-phpapp02/85/Atomistica-437-320.jpg)


































