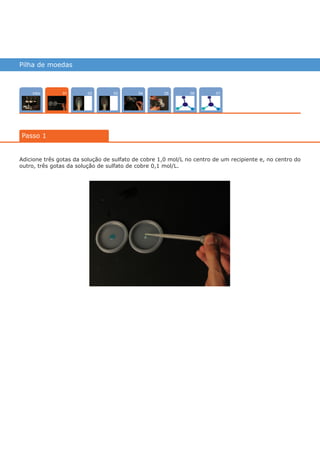
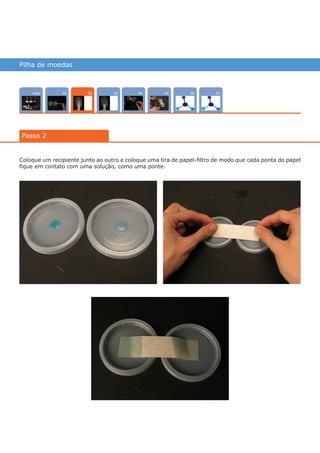
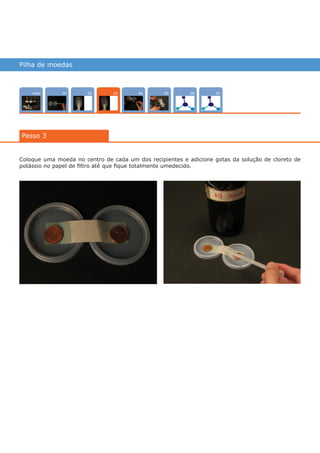
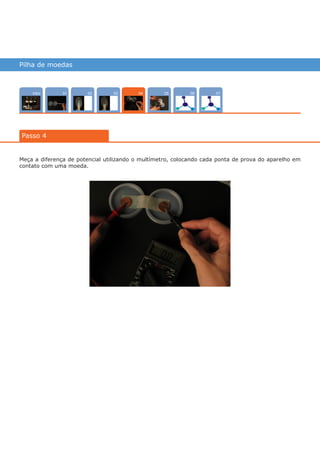
Este documento descreve um experimento para construir uma pilha de concentração iônica usando moedas de cobre em soluções de sulfato de cobre com diferentes concentrações. A diferença de potencial entre as moedas é medida usando um multímetro e aumenta quando hidróxido de sódio é adicionado à solução menos concentrada, deslocando o equilíbrio químico. O experimento ilustra como as pilhas de concentração geram energia elétrica a partir de diferenças de concentração iônica.