1) O documento lista tarefas para a próxima aula sobre ligação metálica e iônica, incluindo exercícios do livro e apostila.
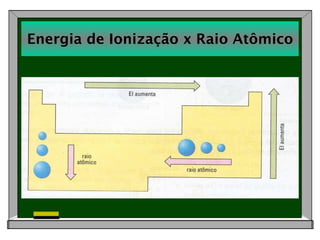
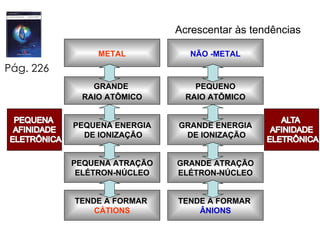
2) Discute propriedades periódicas dos elementos como raio atômico, energia de ionização e afinidade eletrônica e como elas se relacionam com metais e não-metais.
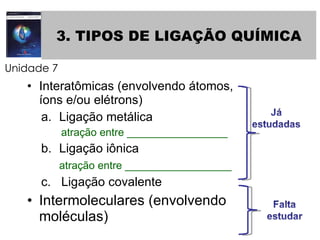
3) Apresenta os tipos de ligação química - metálica, iônica e covalente - e como eles se relacionam com as propriedades das subst