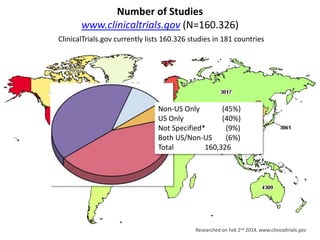
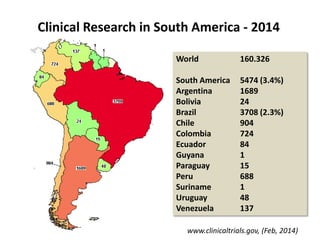
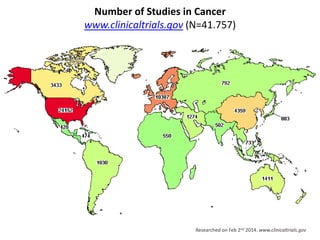
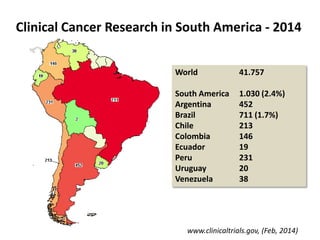
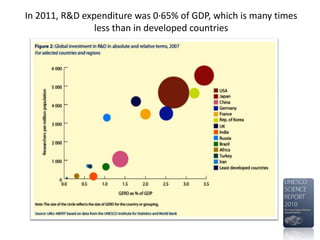
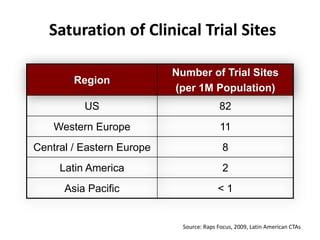
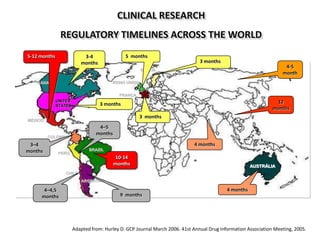
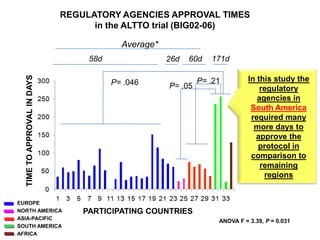
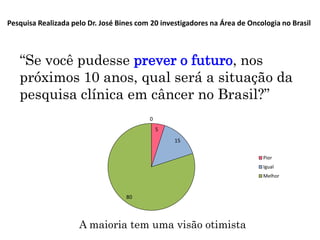
A pesquisa clínica na oncologia no Brasil enfrenta desafios significativos, incluindo tempos regulamentares longos e burocracia excessiva, resultando na perda de estudos e oportunidades de tratamento. O país ocupa uma posição insatisfatória no cenário global de pesquisa clínica, com necessidade urgente de aprimorar a colaboração e investimento na área. É crucial reconhecer as barreiras existentes e desenvolver uma cultura de cooperação para melhorar a pesquisa e os resultados no tratamento do câncer.