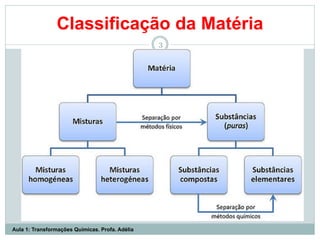
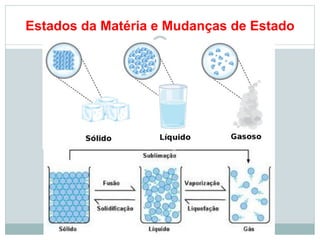
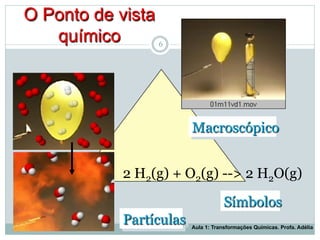
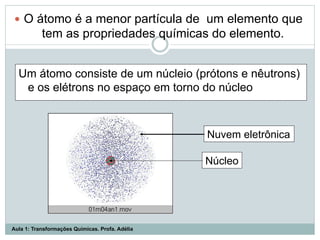
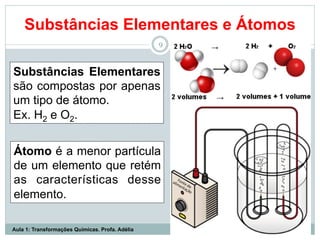
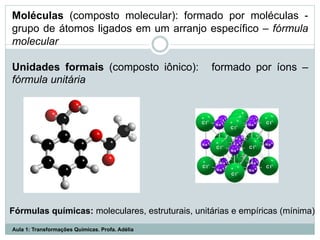
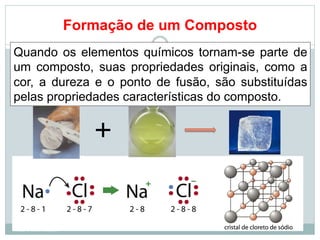
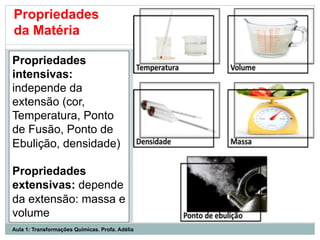
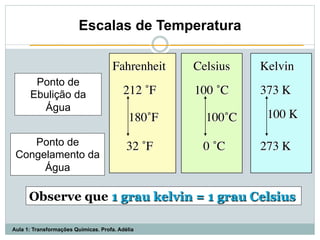
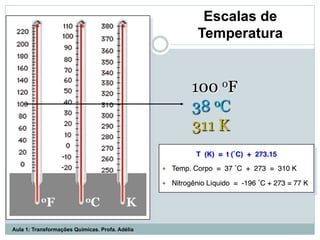
O documento apresenta os objetivos da aula de introdução à química, que são reconhecer elementos, substâncias, átomos, compostos e moléculas, e identificar propriedades e mudanças físicas e químicas. Também define química como a ciência que estuda a natureza e transformações da matéria, e introduz os conceitos de elemento, átomo, composto, molécula, estado da matéria e propriedades físicas.