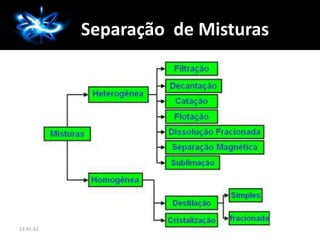
Este documento apresenta os principais tópicos de uma aula de Química sobre conceitos básicos da disciplina. Inclui definições de substâncias simples e compostas, moléculas, misturas homogêneas e heterogêneas, além de exemplos e exercícios propostos.