Geometrias moleculares e polaridade
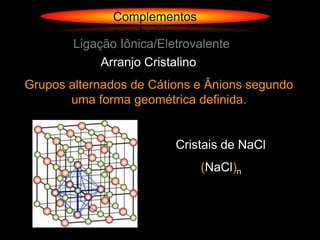
- 1. Complementos Ligação Iônica/Eletrovalente Arranjo Cristalino Grupos alternados de Cátions e Ânions segundo uma forma geométrica definida. Cristais de NaCl (NaCl)n
- 2. Complementos Ligação Iônica/Eletrovalente Número de Coordenação Chamamos de números de coordenação de um íon o número de íons que o cercam em um arranjo cristalino. Podemos observar que, nesse cristal, cada íon Na1+ é cercado por 6 íons Cl1- e vice- versa. Portanto, o número de coordenação do sódio, assim como o do cloro, nesse composto, é igual a 6.
- 3. Complementos Ligação Covalente/Molecular Geometria Molecular É o estudo de como os átomos estão distribuídos espacialmente em uma molécula.
- 4. Complementos Molécula Formada por Duas Espécies A geometria será sempre linear ou digonal, independentemente dos átomos envolvidos: H H F F H Cl O O C O
- 5. Complementos Molécula Formada por Três Espécies A geometria será Linear se o átomo central não apresentar par de elétrons emparelhados disponíveis. O C O S C S O N N N O N H C N
- 6. Complementos Molécula Formada por Três Espécies A geometria será angular se o átomo central apresentar par de elétrons emparelhados disponíveis. O H S O H O S H N O H Cl
- 7. Complementos Moléculas Formadas por Quatro Átomos, com Um Átomo Central. A Geometria será trigonal plana (triangular), se o átomo central não possuir pares de elétrons emparelhados disponíveis. O O S C O O H H
- 8. Complementos Moléculas Formadas por Quatro Átomos, com Um Átomo Central. A Geometria será trigonal plana (triangular), se o átomo central não possuir pares de elétrons emparelhados disponíveis. O O C N Cl Cl O Cl
- 9. Complementos Moléculas Formadas por Quatro Átomos, com Um Átomo Central. A Geometria será piramidal (pirâmide trigonal), se o átomo central apresentar par de elétrons emparelhados disponíveis. N N H H Cl Cl H Cl
- 10. Complementos Moléculas Formadas por Quatro Átomos, com Um Átomo Central. A Geometria será piramidal (pirâmide trigonal), se o átomo central apresentar par de elétrons emparelhados disponíveis. P S I I Cl Cl I O
- 11. Complementos Moléculas Formadas por Cinco Átomos, com Presença de Um Átomo Central A geometria será sempre tetraédrica, independentemente dos átomos envolvidos. H H C C H H Cl Cl H Cl 109° 28’
- 12. Complementos Moléculas Formadas por Cinco Átomos, com Presença de Um Átomo Central A geometria será sempre tetraédrica, independentemente dos átomos envolvidos. Cl O Si P Cl Cl Cl Cl Cl Cl 109° 28’
- 13. Complementos Molécula Formada por Seis Átomos, com Presença de Um Átomo Central A geometria será bipirâmide triangular ou bipirâmide trigonal. Cl 90° Cl Cl 120° P Cl 180° Cl
- 14. Complementos Moléculas Formadas por Sete Átomos, com Presença de Um Elemento Central A geometria será octaédrica. F F F 90° S F F 180° F
- 15. Complementos Ligação Covalente/Molecular Polaridade H2 H H H H H H 0,30 A 0,30 A Ligação Apolar
- 16. Complementos Ligação Covalente/Molecular Polaridade HCl H Cl H Cl H Cl 0,48 A 0,15 A Ligação Polar
- 17. Complementos Ligação Covalente/Molecular Polaridade das Ligações Elementos Eletronegatividades Ligação Iguais Iguais Apolar H H Cl Cl P H Elementos Eletronegatividades Ligação Diferentes Diferentes Polar H Br I Cl S O
- 18. Complementos Ligação Covalente/Molecular Polaridade das Moléculas Momento Dipolar μ=0 Molécula Apolar μ≠0 Molécula Polar
