Sistema tampão e suas aplicações biológicas
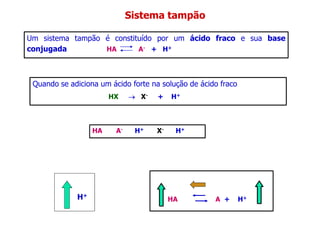
- 1. Sistema tampão Um sistema tampão é constituído por um ácido fraco e sua base conjugada HA A- + H+ HA A- H+ X- H+ Quando se adiciona um ácido forte na solução de ácido fraco HX → → → → X- + H+ H+ HA A + H+
- 2. Quando se adiciona um álcali na solução de ácido fraco BOH → → → → B + OH- Sistema tampão HA A- + H+ OH- + H+ H 2 O Resultado Resultado H+ HA A- + H+
- 3. Equação de Henderson-Hasselbach Equação de Henderson-Hasselbach relaciona a Keq (Ka) e as [Ácido] e [Base conjugada] pH = pKa + log [A-] [HA]
- 4. A eficiência de um tampão está restrita a uma faixa de pH pH = pK + log [A-] pH = pK + log [base conjugada] pH = pKa + log [A-] [HA] pH = pKa + log [base conjugada] [ácido conjugado] pKa = pH que provoca 50% de dissociação do ácido [HA] = [A-] A eficiência máxima de um tampão é no pH correspondente a seu pKa Depende também da concentração das espécies
- 6. Características de Tampões Ácido Base Ka pKa Conjugada (pH ácido 50% dissociado) H3PO4 H2PO4 - 7,2 x 10-3 2,14 Ác. Acético Acetato 1,7 x 10-5 4,76 H2CO3 HCO3 - 4,3 x 10-7 6,1 NH4 + NH3 5,6 x 10-10 9,25 4 3
- 8. Tampões biológicos e suas atuações contra variação Tampões biológicos e suas atuações contra variação Tampões biológicos e suas atuações contra variação Tampões biológicos e suas atuações contra variação do pH do pH do pH do pH Muitas reações químicas que ocorrem dentro de uma célula, ou mesmo fora delas, dependem do pH. Pequenas variações no pH podem afetar a velocidade de uma reação química ou mesmo não permitir que ela ocorra, o que pode acarretar na morte celular. permitir que ela ocorra, o que pode acarretar na morte celular.
- 9. Tampões biológicos e suas atuações contra variação Tampões biológicos e suas atuações contra variação Tampões biológicos e suas atuações contra variação Tampões biológicos e suas atuações contra variação do pH do pH do pH do pH Durante o metabolismo celular ocorre liberação ou consumo de muitos ácidos e que são constantemente liberados no meio celular ou extracelular (corrente sanguínea). O organismo neutraliza estes ácidos para prevenir alterações na quantidade de H+ e preservar a ácidos para prevenir alterações na quantidade de H+ e preservar a função celular. A variação do pH também pode ocorrer por meio de administração de medicamentos ou então serem geradas devido a problemas fisiológicos ou doenças. A forma como o organismo regula a concentração de H+ é de fundamental importância e ocorre no interior das células (líquido intracelular), entre as células (líquido intersticial) e no sangue (líquido intravascular).
- 10. Tampões biológicos e suas atuações contra variação Tampões biológicos e suas atuações contra variação Tampões biológicos e suas atuações contra variação Tampões biológicos e suas atuações contra variação do pH do pH do pH do pH Os mecanismos de defesa do organismo contra alterações do pH são químicos ou então fisiológicos e ambos estão interligados. Os mecanismos químicos são representados pelas substâncias químicas que se encontram dissolvidas no plasma, líquido intersticial ou líquido intracelular e que agem como ácidos e bases neutralizando o aparecimento de quaisquer ácidos ou bases oriundos do próprio metabolismo, medicamento ou distúrbios fisiológicos (sistemas-tampão). Os mecanismos fisiológicos são representados pelos pulmões e pelos rins, que eliminam substâncias indesejáveis ou em excesso, ácidas ou bases, e reservam outras, dependendo da necessidade momentânea do indivíduo.
- 11. Tampões biológicos e suas atuações contra variação Tampões biológicos e suas atuações contra variação Tampões biológicos e suas atuações contra variação Tampões biológicos e suas atuações contra variação do pH do pH do pH do pH A tabela abaixo mostra alguns dos tampões importantes no organismo vivo e as suas quantidades relativas: Composição do sistema Percentual / % Bicarbonato/gás carbônico 64 Hemoglobina/Oxihemoglobina 28 Proteínas ácidas/Proteínas básicas 7 Fosfato monoácido/fosfato diácido 1
- 12. O íon bicarbonato é o principal responsável pelo tamponamento do sangue humano. Como se forma o íon bicarbonato ?
- 13. Como se forma o íon bicarbonato no sangue No metabolismo os compostos são oxidados no interior da célula: Composto + O2 CO2 + H2O No sangue: CO2 + H2O H2 CO3 H2 CO3 é um intermediário instável H2 CO3 é um intermediário instável H2 CO3 H+ + HCO3 - CO2 + H2O H2 CO3 H+ + HCO3 -
- 14. No sangue: CO2 + H2O H2 CO3 A velocidade de formação de H2CO3 a partir de CO2 e H2O, que normalmente é lenta, é muito aumentada pela enzima anidrase carbônica, encontrada nas hemácias
- 15. CO2 + H2O H2 CO3 H+ + HCO3 - O bicarbonato, HCO3 -, está em equilíbrio com CO2 e H2CO3 (ácido carbônico) H2CO3 é um ácido fraco com pKa igual a 3,77 Quando o pH do meio está acima do seu pKa, como geralmente ocorre, H2CO3 degrada-se em HCO3 - e H+
- 16. Tampões biológicos A capacidade de tamponamento (ou "poder tampão") é uma propriedade importante em sistemas biológicos, para os quais uma alteração rápida de pH pode ter conseqüências desastrosas. pode ter conseqüências desastrosas. O tampão bicarbonato/ácido carbônico (pKa = 6,1) mantém o pH do sangue numa "faixa segura" compreendida entre 7,35 e 7,45, resistindo às numa "faixa segura" compreendida entre 7,35 e 7,45, resistindo às variações de pH para cima ou para baixo desses valores.
- 17. De forma geral, quando um indivíduo tem o pH sangüíneo abaixado para níveis inferiores a 7,35 diz-se que ele está com acidose. Quando o pH sangüíneo é aumentado a níveis superiores a 7,45 Quando o pH sangüíneo é aumentado a níveis superiores a 7,45 diz-se que o mesmo está com alcalose.
- 18. Quando a alcalose ou acidose são obtidas por alteração da freqüência respiratória, diz-se que são de origem respiratória. Acidose respiratória e alcalose respiratória. Acidose respiratória: caracterizada por diminuição do pH e Causas da hipoventilação: obstruções no trato respiratório, pneumonia, enfisema, transtornos neuromusculares, doenças ou drogas que deprimem o SNC (centro respiratório) ou inalação de Acidose respiratória: caracterizada por diminuição do pH e aumento da pCO2. Ocorre devido a uma hipoventilação pulmonar que leva ao acúmulo de CO2. drogas que deprimem o SNC (centro respiratório) ou inalação de CO2 em excesso. Resposta compensatória: - rim: aumento da retenção de HCO3 - e excreção de íons H+
- 19. Alcalose respiratória: caracterizada por aumento do pH e diminuição da pCO2. Ocorre devido a uma hiperventilação pulmonar. Causas da hiperventilação: febre, ansiedade, dor intensa ou Causas da hiperventilação: febre, ansiedade, dor intensa ou estresse, diminuição da pressão atmosférica (grandes altitudes). Resposta compensatória: - rim: diminuição da retenção de HCO3 - e da excreção de íons H+
- 20. A acidose e alcalose podem ainda ocorrer por meios metabólicos. Acidose e alcalose metabólica. Acidose metabólica: caracterizada por queda no pH e na Acidose metabólica: caracterizada por queda no pH e na concentração de HCO3 -. Causas: aumento de íons H+ ou perda de bicarbonato. Aumento de H+: acúmulo de ácido lático ou corpos cetônicos, exercício exagerado, jejum prolongado e diabetes. Perda de HCO3 -: falha renal na retenção de HCO3 - ou na excreção de H+, ou perda de bicarbonato devido a uma diarréia severa.
- 21. Efeito compensatório - pulmão: hiperventilação = diminui a pCO2 - rim: aumento da reabsorção de HCO3 - e excreção de íons H+
- 22. Alterações para valores ácidos (i.e., abaixo de 7,35) são particularmente prováveis, tendo em vista a variação na produção, pelo Acidose Metabólica particularmente prováveis, tendo em vista a variação na produção, pelo metabolismo, de ácidos como o láctico, o pirúvico, o acético, etc. Durante o exercício físico intenso o pH do sangue periférico pode ir a valores Exemplo: Durante o exercício físico intenso o pH do sangue periférico pode ir a valores inferiores a 7,0 (pois forma-se ácido láctico).
- 23. O que acontece na Acidose? Pulmão pH < CO2 + H2O H2 CO3 H+ + HCO3 - Com a expiração de CO2 o pH do sangue volta ao normal.
- 24. Alcalose metabólica: caracterizada elevação no pH e na concentração de HCO3 -. Causas: ingestão excessiva de álcalis (exemplo bicarbonato de Causas: ingestão excessiva de álcalis (exemplo bicarbonato de sódio como antiácido) ou perda de ácido pelo organismo, como ocorre no vômito prolongado. Resposta compensatória: - pulmão: reduz a taxa de ventilação = aumento da pCO2 - pulmão: reduz a taxa de ventilação = aumento da pCO2
- 25. No interior das células as proteínas e o tampão fosfato No interior das células as proteínas e o tampão fosfato (pKa = 6,8) exercem efeito tamponante. O tampão bicarbonato é o principal tampão da saliva. *Importância nos ruminantes (manter pH do rúmen).
- 26. Intervalo ideal do pH ruminal: 6,2 a 6,8 Aumento ou queda do pH ruminal abaixo do intervalo Aumento ou queda do pH ruminal abaixo do intervalo ideal diminui e eficiência das bactérias. A digestão se tornará mais lenta causando diminuição na produção de leite ou no ganho de peso. *Uso de tamponantes nas rações: p. ex. bicarbonato de *Uso de tamponantes nas rações: p. ex. bicarbonato de sódio *Infusão de soluções tamponantes: p. ex. bicarbonato ou lactato de sódio
- 27. BICARBOATO DE SÓDIO O Bicarbonato de Sódio “Arm Hammer” tipo “Nutrição Animal fabricado pela Química Geral do Nordeste S.A. é um pó cristalino* de coloração branca ou levemente rosada, usado em rações de ruminantes como tamponante ruminal, e em rações de aves e suínos no Balanço do Equilíbrio Eletrolítico. Produtos: Carbonor A: 99% de Bicarbonato de Sódio. Indicado para uso em Ruminantes, Aves e Suínos Bicarbon TS Feed: 99 % de Bicarbonato de Sódio. Indicado para uso em Ruminantes, Aves e Suínos. Bicarbon TR: 86% de Bicarbonato de Sódio e 14% de Carbonato de Bicarbon TR: 86% de Bicarbonato de Sódio e 14% de Carbonato de Sódio. Indicado para uso em Ruminantes. http://www.milkpoint.com.br/mn/hotsites/QGN/