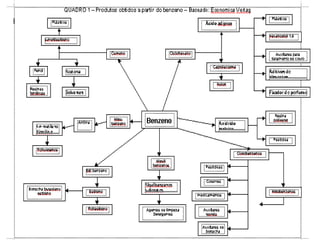
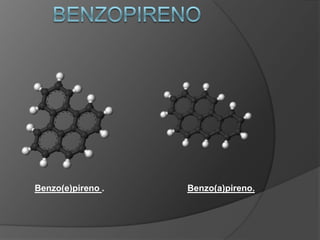
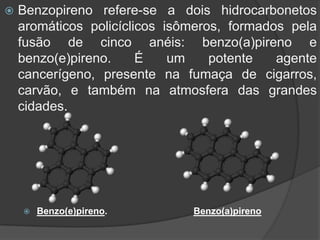
O documento descreve as propriedades do benzeno, incluindo ser um hidrocarboneto aromático, líquido e volátil que é altamente inflamável e explosivo em certas concentrações. Também discute a origem e usos do benzeno, que é extraído principalmente de petróleo.