O documento descreve um experimento para medir propriedades térmicas de materiais usando um calorímetro e resistor. A lei de Fourier é usada para relacionar o fluxo de calor à variação de temperatura através de um material. Equações matemáticas são desenvolvidas para relacionar a variação de temperatura ao longo do tempo à massa e calor específico da água no calorímetro.
![1 – Introdução
1.1 Lei de Fouriere condução térmica
No diaa dia das pessoasacondução de calor ocorre constantemente.Esse processoconsiste
na transferênciade energiageradadevidoaumagradiente de temperatura,ouseja,é a
transferênciade calorentre sistemascomdiferençasde temperatura,onde osistemade maior
temperaturatransfere energiaparao de menortemperatura,como objetivode equipararas
temperaturas.[1] Existemdiversosmodelosque tentamexplicaresse fenômeno.Umdelesé a
Lei de Fourier,ouLei da Conduçãotérmica.EssaLei foi estabelecidaapartirde experiências
vividase consistiuemestabeleceraproporcionalidadeentre ofluxode caloraolongode um
material e a gradiente negativadatemperatura.EnunciandoaLei de Fouriertemosque a
quantidade de calortransferidaemummaterial,porcondução,é igual ao produtodas
quantidadesaseguir:[6]
𝑑𝑄
𝑑𝑡
= −𝑘. 𝐴.
𝑑𝑇
𝑑𝑥
(1)
Onde,
𝑑𝑄
𝑑𝑡
= fluxode calorpor condução(Kcal/hnosistemamétrico);
k= condutividade térmicadomaterial;
A= área da seção atravésda qual o calor flui porcondução,medidaperpendicularmente à
direçãodo fluxo(m²);
𝑑𝑇
𝑑𝑥
= gradiente de temperaturanaseção,istoé,a razão de variaçãoda temperaturaT com a
distância,nadireção x dofluxode calor(°C/h).
O fator de condutividadetérmica,k,é umapropriedade de cadamaterial e revelaafacilidade
que o material apresentaàconduçãode calor. Quandoo valorde k é alto o material é
consideradoumcondutortérmico,casocontrário,o material é isolante térmico.Osinal
negativodispostonaequaçãosugere que adireçãodoaumentoda distânciax,deve sera
mesmadireçãodofluxode calorpositivo,ouseja,comoo calorflui do pontoonde a
temperaturaé maiselevadaparao pontode temperaturamaisbaixao gradiente é negativo,
portanto,o fluxosóé positivose a gradiente tambémfore,porisso,multiplica-se por-1.[7]
1.2 Calorímetro
O calorímetroé uminstrumentoisoladotermicamente doambiente externomuitoutilizado
para a realizaçãode medidasde quantidadesde calorque podemsercedidasouabsorvidas
por meiode mudançasde estadode um sistema.Comocalorímetropode-se determinar
caloresespecíficose capacidade térmicade substânciase caloresde transformaçãode
estados.[2]
O funcionamentodocalorímetroacontece daseguinteforma:Umtermômetroé colocado
juntoa ele de modoque alcance a substâncianointeriordocalorímetro.Oagitadordeve ser
sempre utilizadode modoaagitar o sistemae fazercom que ele alcance oequilíbriotérmico
maisrapidamente.Colocando-se corposde diferentestemperaturasemseuinterior,ocorre
troca de calorentre elesaté que se atinjao equilíbriotérmico.Osistemadoexperimento
realizadoé compostoporuma fonte de tensão,que apresentaumadiferençade potencial
elétricopré-determinadoconstante,umresistorresponsávelpelaconversãodaenergia](https://image.slidesharecdn.com/relatorio3-161025174139/75/Relatorio3-1-2048.jpg)
![elétricaemtérmicaatravésdoefeitoJoule e umcalorímetro.A tensãoa qual apresentaum
valorconstante é distribuídanoresistor a fimde que ocorra a dissipaçãodapotênciano
resistor[3].Alémde a potênciaserumagrandezaque mede a quantidade de energiadissipada
emum determinadointervalode tempo,elatambémpode serdefinidacomoaenergia
dissipadapeloresistoratravésdaseguinte Equação1 [5]:
P = iU (2)
Onde,
P = potênciadissipada(W);
i = corrente elétrica(A);
U = diferençade potencial elétricodosistema(V);
A fonte de tensãoproduziuumaenergiaelétricaaqual pode sermedidapelaLei de Ohme
tambématravésda razão entre a energiaenvolvidae otempo:
P =
𝐸
𝑡
(3)
Onde,
E = variaçãode energiaaplicadapelafonte de tensão (J);
t = variaçãodo tempo(s);
Quandoa energiaé transferidadafonte de tensãoaté o calorímetro,o resistorconverte essa
energiaelétricaemenergiatérmica,aqual seráintroduzidanocalorímetro.Supõe-se que toda
energianaforma de calor é utilizadaparaaquecera água, considerandodesprezível o
aquecimentodocalorímetro.Sabe-se tambémque osistemaé isoladoporumisoporque
envolve ocalorímetro,porémaindaháuma pequenadissipaçãode calor,aqual é desprezada
no experimento.[1] Apósaenergiaelétricasertransformadaemenergiatérmica,aágua é
aquecidaporuma quantidade de calor(Q). Comoa água não sofre mudançade estado,a
seguinte equaçãopode serdescritacomo:
Q = m.c.T (4)
Onde,
Q = quantidade de calor(J);
m = massade água (Kg);
c = calor específicodaágua (
𝐽
𝑘𝑔.𝐾
);
T = variação da temperatura(K);
Comofoi consideradoque todaenergiaelétricaé convertidaemenergiatérmica,podemos
afirmarque:
dQ = dE (5)](https://image.slidesharecdn.com/relatorio3-161025174139/85/Relatorio3-2-320.jpg)
![2 - Modelo e Metodologia
2.1 – Modelo
Para a absorção ou remoçãode calor de sólidose líquidos,tem-sealgumasrelações
importantes,umadelasé acapacidade térmica(C).Ela é a razão docalor (Q) recebidoou
cedidoe a variação da temperatura( ) de um corpo.Ela é medidaemunidadesde energiapor
grau Celsius(J/°C) ouenergiaporKelvin(J/K) [2].Elaé representadacomo:
𝐶 =
𝑄
∆𝑇
Para um corpo,a capacidade térmicaé proporcional àmassa,entãodefine-se uma
“capacidade térmicapor unidade de massa(m)”,chamadade calor específico(c).Que é
referente aumaquantidade de massadaqual o objetoé feito.Essarelaçãopode serescrita
como[2]:
𝑐 =
𝑄
𝑚𝑖∆𝑇
. (2)
Comofoi descrito,doiscorposirãotrocar calor quandoforemcolocadosemcontatoum com o
outro,e de acordo o Princípioda Conservaçãode Energia,emumsistemaisolado,asomada
quantidade de calortrocada entre eles,ocalorrecebidomaisocalor cedido,é zero[3].
Um sistemaisoladopode serrepresentadoporumcalorímetro,que é umaparelhocujas
propriedadesnãopermitemtrocasde calorcom o ambiente [3].
Uma forma de estudaras propriedadesdaáguacomo o calor específico,pode serfeitaemum
calorímetrocom uma determinadacapacidade térmica,e utilizando-sede umresistor.O
resistoré um aparelhocondutorque quandohápassagemde corrente elétricaele aquece [3].
Issose dá pelatransformaçãode energiaelétricaemcalor,denominadoefeitoJoule [3].A
passagemde corrente elétricaemumresistorpode serlimitada,dependendodomaterial.
Essa propriedade é chamadade resistênciaelétrica(R) [3].
A taxade calor que é dissipadaemumresistorporunidade de tempoé denominadapotência,
e pode serescritaemfunçãoda resistênciaelétricae datensão(oudiferençade potencial),
que pode serescritacomo[4]:
𝑃 =
𝑈²
𝑅
A potênciatérmicapode serescritacomona Eq. 6 [2],que é a taxa de calor dissipadopor
unidade de tempo:
. (6)
Essa Eq. 6 pode serreescritacomo:
Onde considerandoque apotenciaé constante,pode-se integrarambososladosda Eq. 7
obtendo-se:
.
Assimconsiderandoumsistemaisoladoformadoporumcalorímetroe por umamassa de
água, pode-se escreverequaçãoparaConservaçãode Energianele,como:
Onde igualandoessaEq.9 com a Eq. 8 e substituindoovalordapotenciapelovalordaEq. 5,
obtém-se:](https://image.slidesharecdn.com/relatorio3-161025174139/85/Relatorio3-3-320.jpg)
![Onde,isolando-se avariaçãode temperatura,obtém-se:
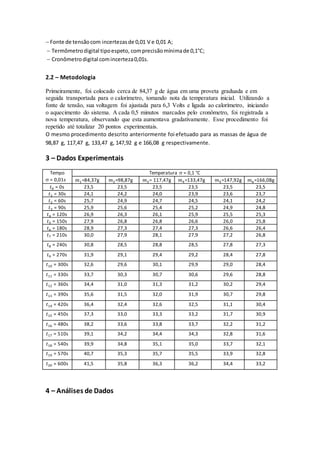
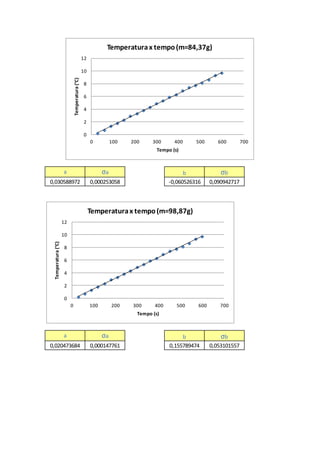
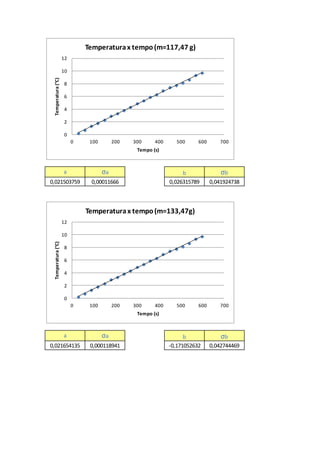
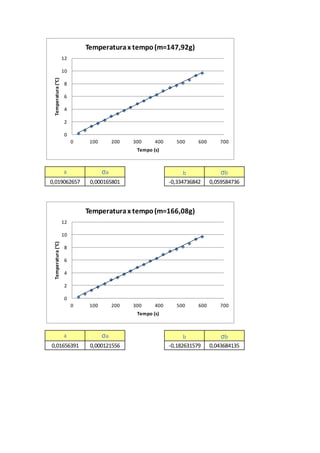
É possível observarque aEq. 11 representaumaequaçãolinear,onde tem-seavariaçãode
temperatura( ) emfunçãoda variação do tempo( ),podendoassimrelacionarcoma equação
do primeirograu[5],representada:
, (12)
onde , , e são escritosnasEq. 13, 14, 15 e 16, respectivamente,apartirdas relaçõesdasEq.11
e 12:
, (13)
, (14)
(15)
e
. (16)
Utilizando-sedaEq.15, e fazendoadistributivadostermos,obtém-se:
. (17)
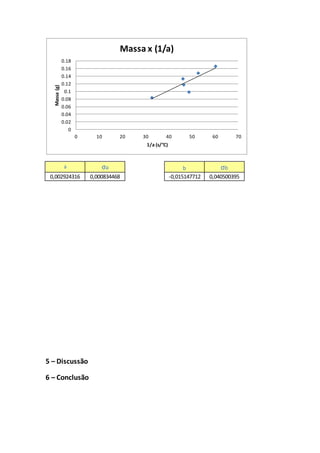
Onde colocando-se amassaemfunçãodo coeficienteangular,tem-se:
(18)
Onde é possível notarque essaEq. 18 representaumarelaçãolinear,onde tem-seamassa( )
emfunção docoeficienteangular( ),podendoassimrelacionarcomaequaçãodo primeiro
grau escritana Eq. 12. Onde , , e o coeficiente agulare ocoeficiente linearsãoescritosnasEq.
19, 20, 21 e 22, respectivamente,apartirdasrelaçõesdasEq. 12 e 18:
, (19)
, (20)
(21)
e
. (22)](https://image.slidesharecdn.com/relatorio3-161025174139/85/Relatorio3-4-320.jpg)
![Utilizando-sedaEq.15, e fazendoadistributivadostermos,obtém-se:
. (17)
Onde colocando-se amassaemfunçãodo coeficienteangular,tem-se:
(18)
Onde é possível notarque essaEq. 18 representaumarelaçãolinear,onde tem-seamassa( )
emfunção docoeficienteangular( ),podendoassimrelacionarcomaequaçãodo primeiro
grau escritana Eq. 12. Onde , , e o coeficiente agulare ocoeficiente linearsãoescritosnasEq.
19, 20, 21 e 22, respectivamente,apartirdasrelaçõesdasEq. 12 e 18:
, (19)
, (20)
(21)
e
. (22)
Para os modelostrabalhados,é precisoconsideraroserrosdas variáveiseme .Porém,
segundoVuolo(1996) é complicadoe desnecessárioutilizarasduas incertezas.Épreciso
conhecera aproximaçãopara essasduasvariáveis.Assimoautoradmite que é o valor
verdadeiro,porémtemincertezamaior,que pode serescritacomo[5]:
( ) (23)
onde é o erro original e (dy/dx)é umaestimativapreliminarparaa derivadade emrelaçãoa .
Assimoerro de y com a transferênciadoerrode x poderser escritocomo:
(24)
Numaprimeiraparte,utiliza-se ométodoestatístico ()[5] considerandoapenasoerroem,
para obtençãodo coeficiente angular,e numasegundaetapaseráconsideradooerro de com
incertezade que foi transferida.
Então para a primeiraé possível encontrarovaloresde e a partirdo métodoestatístico ()
(qui-quadrado)[5],que é definidacomo:
( ) Σ( ) ,(25)
onde para esse modelo,é a i-ésimamedidade variaçãode tempo,é o errodas medidasem.
SubstituindonaEq.25, obtém-se:
( ) Σ( ) .(26)
Para achar a melhorretaque se ajustaaos dadosderiva-se parcialmente ()em relaçãoa e a
conforme Eq.27 e 28[5]:
(27)
e
. (28)
Assimobtém-se [5]:
(29)
e [5]:
(30)
onde os termosβ, αx, αyy,αy, αxx e αxy são [5]:
Σ , (31) Σ , (32) Σ , (33)
Σ , (34) Σ , (35)
e
Σ (36)
Comoe são medidasindiretas,elastêmumerro associado,escritocomo[5]:
(37)](https://image.slidesharecdn.com/relatorio3-161025174139/85/Relatorio3-5-320.jpg)
![e
. (38)
Para a segundaparte,serárefeitoométododoqui-quadrado,utilizandoagoraonovo valordo
erro de a partir da Eq. 24. Então a novaequaçãodo métodopode serescritacomo:
( ) Σ( ) .(39)
Assimpoderáseraplicadoométododo qui-quadradoparaencontrarosvaloresdocoeficiente
angulare do coeficiente linear,onde oque mudaráserá a relaçãoda Eq. 31, que passa a ser
escritacomo na:
(40)
Para o valorde da Eq. 20, tem-se umerro associado,paraissoseráutilizadodométodode
propagação de incertezas[5] paraencontrara equaçãopara o calculodesse erro,que será
escritacomo:
√( ) , (41)
onde é o erro referente aocoeficienteangularcalculadonaEq.37. DiferenciandoessaEq.40,
emrelaçãoà Eq. 20, obtem-se:
(42)
Para o cálculodo calor específicoseráutilizadoaEq.21 e para o cálculoda capacidade térmica
do calorímetroseráutilizadoaEq. 22, isolandocadaumdessasvariáveis,obtém-seessas
relações:
(43)
e
. (44)
Comoessesvaloressãomedidaindiretas,é precisocalcularoerrosdessasmedidas,ométodo
utilizadoseráode propagação de incertezas[5],podendoescreveraequaçãode propagação
para a Eq.43 como:
√( ) ( ) ( ) , (45)
onde é o erro referente àmedidadatensãoelétrica,é oerroreferente àresistênciaelétricae
é o erroreferente aocálculodocoeficiente angularcalculadoapartirda Eq. 37. Diferenciando
essaEq. 45, obtém-se aequaçãopara o calculodoerro referente aocalorespecífico:
√( ) ( ) ( ) . (46)
Para o cálculodo erroreferente àcapacidade térmica,pode-seescreveraequaçãode
propagação de incertezaparaa Eq. 44 como:
√( ) ( ) (47)
onde é o erro referente aocálculodocoeficiente linearcalculadoapartirda Eq. 38 é o erro
referente aocalorespecificocalculadonaEq.46. DiferenciandoessaEq.47, obtém-se a
equaçãopara o calculodo erro referenteàcapacidade térmica:
√( ) ( ) . (48)
Para o erro referente àmedidade variaçãode temperatura,Eq.3,a propagaçãode incertezas
será escritacomo:
√( ) ( ) . (49)
Resolvendoessadiferencial e considerandoque oerrodastemperaturas( e ) são iguais,jáque
o termômetroé o mesmo,tem-se aincertezadavariaçãoda temperatura:
√ . (50)
Para validara melhorretaobtidacom osdados experimentais,usa-se umteste chamadosobre
o valorde encontradoconforme escrito[5]:
(51)
onde é o númerode graus de liberdadedoajuste e é escritocomo[5]:
(52)
onde é o númerode pontose númerode parâmetros.
2.1 – Aparato Experimental
Foram utilizadosparaa realizaçãodoexperimentoosseguintesmateriais:
Calorímetrode resistência2Ω - 3Ω;
Provetagraduadade 250 ml;](https://image.slidesharecdn.com/relatorio3-161025174139/85/Relatorio3-6-320.jpg)